Expert medical al articolului
Noile publicații
Anemie hipofizară (nanism)
Ultima examinare: 12.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Termenul „nanism hipofizar” (din grecescul nanos - pitic; sinonim: nanism, nanosomie, microsomie) în sens absolut înseamnă o boală, a cărei principală manifestare este o întârziere bruscă a creșterii, asociată cu o încălcare a secreției hormonului de creștere de către glanda pituitară anterioară.
Într-un sens mai larg, nanismul este o tulburare de creștere și dezvoltare fizică, a cărei apariție poate fi cauzată nu numai de o deficiență absolută sau relativă a hormonului somatotrop din cauza patologiei glandei pituitare în sine, ci și de o tulburare a reglării hipotalamice (cerebrale) a funcțiilor sale, defecte în biosinteza hormonului somatotrop și tulburări de sensibilitate a țesuturilor la acest hormon.
Cauze nanism
Majoritatea formelor de nanism hipofizar sunt boli genetice. Cea mai frecventă este nanismul panhipopitutar, care se transmite în principal recesiv. Se presupune că există 2 tipuri de transmitere a acestei forme de patologie - autosomală și prin cromozomul X. În această formă de nanism, odată cu defectul în secreția de hormon somatotrop, secreția de gonadotropine și hormon stimulator tiroidian este cel mai adesea perturbată. Secreția de ACTH este perturbată mai rar și într-o măsură mai mică. Studiile funcționale cu hormoni eliberatori, inclusiv hormonul sintetic de eliberare a somatotropinei (format din 29, 40 și 44 de reziduuri de aminoacizi), similar polipeptidei pancreatice, au arătat că majoritatea acestor pacienți au patologie la nivelul hipotalamusului, iar insuficiența glandei pituitare anterioare este secundară. Patologia primară a glandei pituitare în sine este mai puțin frecventă.
Nanismul genetic cu deficit izolat de hormon de creștere, cu activitate biologică afectată și sensibilitate la acesta, se întâlnește sporadic în Rusia și țările vecine. Este mai frecvent pe continentul american, în țările din Orientul Apropiat și Mijlociu și în Africa. Pe baza rezultatelor unui studiu privind conținutul sanguin de hormon somatotrop și sensibilitatea pacienților la hormonul somatotrop exogen, nivelul de insulină imunoreactivă (IRI), factorii de creștere asemănători insulinei (IGF) tip I (somatomedină C) și tip II și răspunsul IGF-1 la tratamentul cu preparate de hormon somatotrop, au fost identificate diverse variante de tipuri de nanism clinic similare.
Recent, a fost descifrată patogeneza nanismului Laron, care este cauzat de o deficiență a IRF-1 și IRF-II, precum și patogeneza nanismului la pigmeii africani, asociată cu o deficiență a primului.
În 1984, a fost descrisă o nouă variantă de nanism pseudohipofizar cu un nivel ridicat de hormon somatotrop și IGF-1; geneza nanismului este explicată printr-un defect al receptorilor săi, dovedit de o scădere bruscă a legării fibroblastelor cutanate de IGF-1.
Trebuie subliniat faptul că în condițiile moderne, cu prezența familiilor mici, multe cazuri izolate („idiopatice”, sporadice) ale bolii pot fi și genetice.
În analiza a 350 de istoricuri clinice, etiologia nanismului a fost neclară la 228 de pacienți (65,2%). Acest grup a inclus pacienți din 57 de familii cu incidență repetată a nanismului (2-4 cazuri per familie), ceea ce a reprezentat 28% din totalul pacienților. În 77% din familiile cu forme de nanism etiologic neclare (în mare parte genetice), s-a stabilit o legătură incontestabilă cu moștenirea absenței factorului Rh. Distribuția factorului Rh în familiile pacienților cu nanism diferă de cea observată în conflictul Rh dintre mamă și făt și, de regulă, nu este însoțită de boală hemolitică a nou-născutului (tatăl poate fi Rh negativ, iar în cazul heterozigoției părinților pentru factorul Rh - copiii etc.). Se poate presupune o legătură între activitatea genelor responsabile de sinteza hormonului somatotrop (sau hormonului de eliberare a somatotropinei) și genele care determină factorul Rh, mai ales că majoritatea formelor de nanism și absența factorului Rh sunt trăsături autozomal recesive. Acest lucru nu explică raritatea relativă a nanismului în comparație cu frecvența indivizilor Rh-negativi din populație. Probabil, unii factori suplimentari încă necunoscuți sunt importanți, dar este puțin probabil ca caracteristicile distribuției factorului Rh în familiile pacienților cu nanism familial și sporadic să fie accidentale.
Un grup mare de pacienți cu nanism (cerebral primar, cerebro-hipofizar) sunt pacienți cu diverse tipuri de patologii organice ale sistemului nervos central, apărute in utero sau în copilăria timpurie. Substratul anatomic care cauzează această patologie poate fi subdezvoltarea sau absența glandei pituitare, distopia acesteia în patologia formării șeii turcice, degenerarea chistică a glandei pituitare, atrofia acesteia datorată compresiei de către o tumoră (craniofaringiom, adenom cromofob, meningiom, gliom). Nanismul poate fi cauzat de leziuni traumatice ale regiunii hipotalamo-hipofizari (intrauterine, la naștere sau postnatale), care apar adesea în sarcinile multiple, precum și în timpul nașterii în poziție pelviană, în prezentarea piciorului sau în poziție transversală cu rotație pe picior (acesta este mecanismul nașterii la mai mult de 1/3 dintre pacienții cu nanism). Leziunile infecțioase și toxice sunt importante (infecții virale intrauterine, tuberculoză, sifilis, malaria, toxoplasmoza; boli la o vârstă fragedă, sepsis neonatal, meningo- și arahnoencefalită etc.). Aceste procese pot afecta glanda pituitară în sine, centrele hipotalamice care reglează funcția acesteia și pot perturba conexiunile funcționale normale din sistemul nervos central.
Leziunile fetale intrauterine pot duce la nașterea unor pacienți cu „nanism de la naștere” cu secreție normală de hormon de creștere (nanism primordial cerebral, microcefalie, nanism Silver-Russell cu hemiasimetrie corporală și niveluri ridicate de gonadotropine etc.).
Factorii suplimentari care agravează încălcarea dezvoltării fizice la nanism pot fi nutriția inadecvată, dezechilibrată în ceea ce privește ingredientele esențiale (deficit de proteine) și microelementele (deficit de zinc), condițiile de mediu nefavorabile, precum și diverse boli cronice, cum ar fi glomerulonefrita, în care azotemia afectează activitatea receptorilor hepatici sau afectează direct metabolismul celulelor hepatice, provocând o scădere a sintezei somatomedinei sau ciroza hepatică, atunci când formarea somatomedinei este afectată.
Patogeneza
La majoritatea pacienților cu nanism hipofizar, modificările nu se limitează la patologia secreției de hormon somatotrop și la sensibilitatea la acesta, ci se extind la alți hormoni tropici ai glandei pituitare, ceea ce provoacă diverse combinații de tulburări endocrine și metabolice.
În deficitul izolat de hormon somatotrop, modificările morfologice ale glandei pituitare au fost puțin studiate. În cazurile studiate, rareori s-au constatat tulburări patologice (craniofaringiom sau hiperostoză a oaselor craniene). În acest tip de nanism, se poate observa o subdezvoltare congenitală a celulelor peptidergice sau un defect al sistemului neurotransmițător din hipotalamus. În astfel de cazuri, nanismul poate fi combinat cu displazie sau hipoplazie a nervilor optici. Chisturile intraselare, tumorile hipofizare și hipotalamice duc la deficit de hormon hipofizar, provocând compresia țesutului hipofizar, în special a somatotrofelor.
Nanismul se caracterizează prin subțierea oaselor, în principal din cauza stratului cortical, diferențierea întârziată și osificarea scheletului. Organele interne sunt hipoplazice, uneori atrofice, iar mușchii sunt slab dezvoltați.
Simptome nanism
Un decalaj accentuat în creștere și dezvoltare fizică sunt principalele manifestări ale nanismului hipofizar. Pacienții se nasc cu greutate și înălțime corporală normală și încep să aibă un decalaj în creștere de la vârsta de 2-4 ani.
Înainte de apariția tratamentului activ pentru nanism, piticii erau considerați cei cu o înălțime mai mică de 120 cm pentru femei și 130 cm pentru bărbați. În prezent, înălțimea unui pitic diferă cu cel puțin 2-3 abateri sigma față de norma tabelară medie pentru un anumit sex, vârstă sau populație. Există, de asemenea, o metodă de evaluare grafică a înălțimii bazată pe curba de distribuție gaussiană. În acest caz, piticii după înălțime sunt incluși într-un grup care include numărul minim de indivizi din populația corespunzătoare cu cea mai mare decalaj față de norma medie de creștere.
Nanismul hipofizar este caracterizat nu numai de dimensiuni corporale absolute mici, ci și de o creștere anuală redusă și o dinamică de dezvoltare fizică redusă. Constituția corporală este proporțională, dar proporțiile corpului pacienților sunt tipice copilăriei. Pielea este palidă, adesea cu o nuanță gălbuie, uscată, ceea ce se datorează insuficienței tiroidiene absolute sau relative, uneori se observă cianoză - „marmorare” a pielii. La pacienții netratați, apare devreme pielea cu aspect îmbătrânit și ridată (gerodermie). Acest lucru se datorează insuficienței acțiunii anabolice a hormonilor tiroidieni (STH) și schimbării lente a generațiilor celulare.
Părul de pe cap poate fi normal sau uscat, subțire, fragil; genele lungi sunt tipice. Creșterea secundară a părului este adesea absentă. Dimensiunea șeii turcice la majoritatea pacienților cu nanism (70-75%) nu este modificată, dar șea își păstrează adesea forma copilărească a unui „oval vertical”, are un spate larg „juvenil”, sinusul osului sfenoid rămâne în urmă în ceea ce privește pneumatizarea. Cu toate acestea, există pacienți cu o șea turcică mărită, ceea ce este un semn al unei tumori; cu zone de calcificare pe fundalul acesteia sau în zona intrării (cu craniofaringiom, efecte reziduale ale neuroinfecției) sau scăderea acesteia (semne de subdezvoltare, dimensiuni mici ale glandei pituitare). Se observă simptome de hipertensiune intracraniană: subțierea oaselor boltei craniene, creșterea modelului vascular, prezența amprentelor digitale etc. Cel mai important semn al nanismului hipofizar este o întârziere în momentul diferențierii și osificării scheletului. Caracteristicile sistemului dentar sunt, de asemenea, strâns legate de diferențierea scheletică: se observă înlocuirea tardivă a dinților de lapte. Cea mai mare întârziere în dezvoltarea sistemului osos se observă la pacienții cu nanism cu insuficiență sexuală și hipotiroidism.
Organele genitale ale majorității pacienților sunt sever subdezvoltate, deși malformațiile sunt rare. Am observat criptorhidie la 5,8% dintre pacienții de sex masculin. Insuficiența sexuală este însoțită de subdezvoltarea caracteristicilor sexuale secundare și scăderea dorinței sexuale, absența menstruației. Dezvoltarea sexuală spontană normală se observă doar la pacienții cu deficit izolat de hormon de creștere și la unii pacienți cu nanism cerebral.
Insuficiența tiroidiană este un simptom destul de frecvent al nanismului. Trebuie menționat că manifestările externe ale hipotiroidismului nu reflectă întotdeauna starea funcțională reală a glandei tiroide. Acest lucru se datorează hipotiroidismului relativ, cauzat de o încălcare a tranziției tiroxinei (T4 ) la triiodotironină (T3 ) și de formarea de T3 inactiv (reversibil) , caracteristic insuficienței somatotrope.
Funcția adrenocorticotropă în nanismul hipofizar scade mai rar și într-o măsură mai mică decât funcțiile sexuale și de stimulare a tiroidei și, la majoritatea pacienților, nu necesită corecții speciale.
În majoritatea cazurilor, intelectul nu este afectat. Se întâlnesc modificări emoționale sub forma infantilismului mental; la pacienții mai în vârstă fără deficiențe intelectuale, uneori se observă nevroze reactive.
În patologia cerebrală organică, în special cea de natură tumorală, nanismul poate apărea cu simptome de diabet insipid, hemianopsie bitemporală și dizabilități intelectuale.
Studiul dezvoltării activității bioelectrice a creierului la pacienți fără simptome organice ale sistemului nervos central a arătat că EEG-ul lor este caracterizat prin trăsături de imaturitate, menținerea pe termen lung a unui voltaj EEG „copilăresc” ridicat; inegalitatea ritmului alfa în amplitudine și frecvență; o creștere bruscă a conținutului ritmurilor θ și δ lente, în special în derivațiile frontale și centrale; o reacție clară la hiperventilație; o deplasare a intervalului ritmurilor EEG în urma ritmurilor de stimulare luminoasă către frecvențe joase (dovadă a unei scăderi a mobilității funcționale a structurilor nervoase ale creierului). S-a constatat că la pacienții mai în vârstă, natura imatură a activității electrice a creierului se datorează subdezvoltării sexuale, iar la pacienții de toate grupele de vârstă - hipotiroidismului.
Metabolismul carbohidraților la pacienții cu nanism se caracterizează printr-o tendință de scădere a nivelului de glucoză din sânge à jeun, o creștere în timpul efortului fizic, insuficiența insulinei endogene, sensibilitate crescută la insulina exogenă cu dezvoltarea frecventă a stărilor hipoglicemice. Aceasta din urmă se explică în principal prin niveluri insuficiente de hormoni contrainsulari în organismul pacienților.
Organele interne prezintă splanchnomicrie, adică o scădere a dimensiunii lor. Nu au fost descrise modificări funcționale ale organelor interne specifice nanismului. Se observă adesea hipotensiune arterială cu scăderea presiunii sistolice și diastolice și scăderea amplitudinii pulsului. Zgomotele cardiace sunt înăbușite, se aud sufluri funcționale de diverse teme din cauza modificărilor trofice ale miocardului și a tulburărilor autonome. ECG-ul se caracterizează prin voltaj scăzut (în special în prezența hipotiroidismului), bradicardie sinusală sau bradiaritmie; PCG-ul prezintă o scădere a amplitudinii tonurilor, tonuri suplimentare și sufluri funcționale. Datele oxigemometriei indică hipoxemie (inițială și în timpul efortului fizic) și datorie de oxigen. Pacienții vârstnici dezvoltă uneori hipertensiune arterială.
Diagnostice nanism
Diagnosticul și diagnosticul diferențial al nanismului se bazează pe datele anamnezice și pe un examen clinic, radiologic, de laborator și hormonal complet. Pe lângă dimensiunea corporală absolută, pentru a evalua creșterea pacienților se determină deficitul de creștere - diferența dintre înălțimea pacientului și norma sa medie pentru sexul și vârsta corespunzătoare; vârsta de creștere - respectarea înălțimii pacientului cu anumite standarde; indicatorul deviației normalizate.
I = M - Mcp / δ, unde M este înălțimea pacientului, Mcp este înălțimea normală medie pentru un anumit sex și vârstă, δ este abaterea pătratică de la Mcp; I mai mic de 3 este tipic nanismului, I mai mare de 3 este tipic gigantismului. Acest indicator poate fi utilizat pentru a evalua dinamica dezvoltării.
Examinarea radiografică a pacienților cu nanism relevă semne de hipertensiune intracraniană, efecte reziduale ale neuroinfecției, calcificări și craniosinostoză. Studiul dimensiunii, formei și structurii sellei turcice este considerat un indicator indirect care caracterizează dimensiunea glandei pituitare. Una dintre cele mai importante manifestări ale retardului patologic de creștere este o încălcare a diferențierii scheletice. Pentru a evalua gradul de maturitate scheletică, se determină vârsta osoasă (radiografică), care corespunde diferențierii țesutului osos; deficiența de osificare este gradul de întârziere a osificării față de normă (în ani), iar coeficientul de osificare este cotientul împărțirii vârstei osoase la parametrii cronologici și alți parametri.
Diagnosticul modern al nanismului este imposibil fără studierea secreției de hormon somatotrop, a nivelului său bazal, a ritmului circadian și a eliberării sub stimulare. Majoritatea pacienților cu nanism hipofizar se caracterizează printr-un conținut redus de hormon somatotrop în serul sanguin. Determinat prin metoda radioimunologică, acesta este (conform diferiților autori) de la (0,87±0,09) la (1,50±0,64) ng/ml, cu o normă medie de (3,81±0,29) ng/ml. Un studiu al ritmurilor zilnice (circadiene) ale secreției de hormon somatotrop a arătat că nivelul acestuia la persoanele sănătoase este maxim în primele 2 ore de somn și la 4-6 dimineața. În nanism, conținutul de hormon somatotrop este redus și în aceste ore.
Pentru a studia rezervele funcției somatotrope, se utilizează diverși stimuli, examinându-se conținutul de hormon somatotrop înainte și după introducerea lor. Se recoltează sânge pentru studiu la fiecare 30 de minute, timp de 2-3 ore. Eliberarea de hormon somatotrop după stimulare este considerată normală cel puțin până la 7-10 ng/ml, uneori ajungând la 20-40 ng/ml. Dacă nu există nicio reacție la una dintre probe, se efectuează teste repetate cu alți stimuli. Insuficiența hormonului somatotrop este considerată dovedită în absența eliberării de hormon somatotrop în 2-3 probe diferite.
Cele mai frecvent utilizate teste de stimulare sunt: prin administrarea intravenoasă a 0,1 U (0,75-1,5 U) de insulină la 1 kg din greutatea corporală a pacientului și realizarea hipoglicemiei (o scădere a nivelului de glucoză din sânge cu 50% față de nivelul inițial), hormonul somatotrop seric se determină conform schemei de mai sus. Dacă apare hipoglicemie severă, testul se întrerupe, iar pacientului i se administrează glucoză intravenos. Aceasta este cea mai comună metodă de diagnostic clasică.
TRH într-o doză de 200-500 mcg administrat intravenos. Identifică eficient rezervele hormonale, nu provoacă complicații. În combinație cu testul de insulină, permite evaluarea nivelului de afectare a sistemului hipotalamo-hipofizar. O reacție pozitivă la TRH în absența hipoglicemiei la insulină indică integritatea glandei pituitare și afectarea la nivel hipotalamic, reacțiile negative la TRH și hipoglicemia indică afectarea glandei pituitare în sine.
TRH, LH-RH la o doză de 300 mcg intravenos este similar cu cel precedent.
SGH uman este un analog sintetic al unui compus biologic activ izolat dintr-o tumoare pancreatică. În prezent, există 3 tipuri de SGH sintetic: cu 29, 40 și 44 reziduuri de aminoacizi. Se utilizează intravenos în doze de la 1 la 3 μg / kg din greutatea corporală a pacientului. Eliberarea de STH se observă la 15-20 de minute după administrare, testul fiind mai eficient decât altele în evidențierea rezervelor de hormon de creștere endogen. O reacție SGH pozitivă indică un nivel hipotalamic de afectare a funcției somatotrope și o glandă pituitară intactă; cu aminoacizi (monoclorură de L-arginină, ornitină, triptofan, glicină, leucină) se administrează intravenos la o doză de 0,25-0,5 g per 1 kg din greutatea corporală a pacientului. Eficient pentru studierea rezervelor de SGH. Poate provoca reacții alergice.
L-dopa administrată oral în doză de 250-500 mcg. Eficientă, bine tolerată de pacienți.
Se utilizează, de asemenea, teste cu glucagon, ergocriptină bromică (parlodel), lizină vasopresină, clonidină și sarcină ergometrică pe bicicletă dozată.
Studiul stării funcției somatotrope este necesar nu numai pentru diagnosticarea nanismului, ci și pentru alegerea justificată a unei metode de terapie, deoarece tratamentul cu somatotropină este rațional numai în cazul insuficienței hormonului de creștere endogen.
Pentru diagnosticarea formei de nanism, este foarte important să se studieze conținutul factorilor de creștere asemănători insulinei sau somatomedinelor (în special IGF-1 sau somatomedina C) - mediatori ai acțiunii hormonului somatotrop la nivel tisular. Se știe că în cazul nanismului conținutul de somatomedină C este redus, iar în cazul acromegaliei - crescut față de normă. Forma de nanism descrisă de Laron este un tip de boală cu producție normală de STH, dar cu o încălcare a formării IGF-1 și IGF-II. Tratamentul acestor pacienți cu somatotropină este inutil.
Indicatorii indirecți ai funcției somatotrope a glandei pituitare sunt activitatea fosfatazei alcaline și conținutul de fosfor anorganic din ser. În condiții hiposomatotrope, acești indicatori sunt reduși. În forma panhipopituitară de nanism, secreția de gonadotropine, adesea TSH, este redusă, ceea ce este însoțit de o scădere corespunzătoare a funcțiilor glandelor sexuale (deficit de androgeni sau estrogeni), glandei tiroide (scăderea nivelurilor de T3 , T4 , iod legat de proteine - PBI, acumularea de 131I de către glanda tiroidă) și glandelor suprarenale (scăderea cantității de cortizol și 17-OCS în plasmă, excreția de 17-KC și 17-OCS în urină, limfocitoză).
Toate tipurile de nanism genetic hipofizar (hipotalamo-hipofizar) se caracterizează prin boli repetate la copiii dintr-o familie, cu transmitere autosomal recesivă (mai des) sau autosomal dominantă, retard de creștere și dezvoltare fizică de la 2-4 ani, cu un decalaj de cel puțin 2-3°C față de normele medii de creștere pentru un anumit sex, vârstă, populație, cu dinamică anuală spontană scăzută, osificare întârziată. Cu un nivel scăzut de hormon somatotrop (în 2-3 teste de stimulare sub 7 ng/ml), terapia cu hormon somatotrop este foarte eficientă (determină o creștere în înălțime de cel puțin 7 cm pe an). Cu un nivel normal sau ridicat de hormon somatotrop (cu inactivitatea sa biologică), sensibilitatea la hormon poate fi menținută. Nu se observă modificări ale inteligenței.
În nanismul genetic cu insensibilitate tisulară la hormonul somatotrop, tabloul clinic este similar cu deficitul izolat de hormon de creștere, dar terapia cu somatotropină este ineficientă. În acest grup, se pot distinge următoarele forme principale în funcție de nivelul IRF: cu conținut normal (defect al receptorului IRF) și redus - nanismul de tip Laron (deficit de IRF-1 și IRF-II) și tipul întâlnit la pigmeii africani (deficit de IRF-1).
Nanismul cerebral este caracterizat prin boli izolate într-o familie asociate cu leziuni intrauterine sau postnatale ale sistemului nervos central, cu prezența unor modificări organice evidente în sistemul nervos central, adesea combinate cu patologia organului vizual, prezența diabetului insipid, conservarea funcțiilor gonadotrope și modificări ale inteligenței.
Unele tipuri de disgenezie și agenezie gonadală sunt însoțite de o statură mică marcată, în special sindromul Shereshevsky-Turner și forma „Turneroidă” (mozaic) a sindromului de disgenezie testiculară. Studiile citogenetice (cromatina sexuală, cariotipul) ajută la diagnosticul diferențial, evidențiind defecte cromozomiale, precum și defecte caracteristice ale dezvoltării somatice și sexuale, niveluri normale sau crescute de hormon somatotrop endogen și insensibilitate la tratamentul cu somatotropină.
Printre tulburările endocrine care apar la persoanele cu statură mică, trebuie evidențiat hipotiroidismul primar, cauzat de hipoplazia sau aplazia congenitală a glandei tiroide, distopia acesteia, defecte enzimatice în biosinteza hormonilor tiroidieni, leziuni autoimune precoce ale glandei tiroide. În toate aceste condiții, predomină semnele de hipotiroidism cu un nivel ridicat de TSH, o scădere a T4 și T3 în serul sanguin. În mixedemul de geneză autoimună, în sânge se detectează anticorpi anti-tiroglobulină, fracții microsomale și nucleare ale țesutului tiroidian, nivelul hormonului somatotrop este normal sau redus. Efectul clinic poate fi obținut doar prin compensarea hipotiroidismului.
Statura mică este însoțită de dezvoltare sexuală prematură și sindrom adrenogenital din cauza închiderii premature a zonelor de creștere; boala Itsenko-Cushing, care apare în copilărie din cauza efectului inhibitor al glucocorticoizilor asupra secreției de hormon somatotrop și a efectului lor catabolic; sindromul Mauriac - statură mică și infantilism la pacienții cu diabet zaharat insulinodependent sever.
Nanismul hipofizar trebuie diferențiat de întârzierea somatogenă a dezvoltării fizice cauzată de tulburări metabolice cronice (în boli ale ficatului, rinichilor, tractului gastrointestinal), hipoxie cronică (în boli ale sistemelor cardiovascular și respirator, anemie); cu boli sistemice ale sistemului musculo-scheletic (condrodistrofie, osteogeneză imperfectă, exostoză) etc.
Retard funcțional (constituțional) al creșterii este uneori observat odată cu debutul tardiv al pubertății la adolescenții aparent sănătoși; am constatat că este asociat în principal cu insuficiența tranzitorie a activității gonadotrope. Secreția de hormon somatotrop nu este de obicei afectată sau este ușor redusă. Stimularea gonadotropinelor poate accelera atât dezvoltarea sexuală, cât și creșterea.
Statura mică de natură familială ar trebui considerată o variantă a dezvoltării fiziologice.
Ce trebuie să examinăm?
Cum să examinăm?
Ce teste sunt necesare?
Cine să contactați?
Tratament nanism
Tratamentul nanismului este un proces lung. Acest lucru obligă medicul să distribuie mijloacele de influențare a creșterii în timp pentru a obține cel mai mare efect clinic, respectând în același timp două principii de bază:
- aproximarea maximă a dezvoltării induse de tratament la condițiile fiziologice;
- menajând zonele de creștere epifizare.
Mulți ani de experiență în tratarea nanismului ne permit să considerăm următoarea schemă de terapie etapizată ca fiind potrivită. Diagnosticul nanismului la pacienții adulți, de obicei, nu ridică îndoieli. La copiii mici, dacă tabloul clinic este neclar, este necesară o perioadă de diagnostic: 6-12 luni sub observație fără terapie hormonală. În acest timp, se prescrie un tratament complex de întărire generală; o nutriție adecvată cu creșterea conținutului de proteine animale, legume și fructe în dietă, vitaminele A și D, preparate de calciu și fosfor. Absența unor modificări suficiente în creșterea și dezvoltarea fizică în acest context și detectarea tulburărilor endocrine în timpul examinării reprezintă baza pentru inițierea terapiei hormonale.
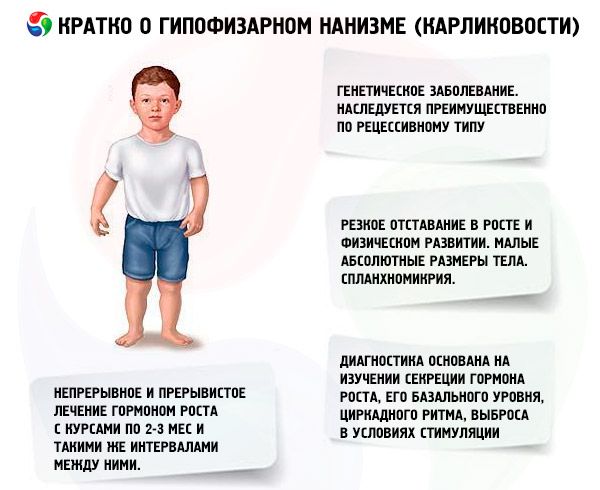
Principalul tip de terapie patogenetică pentru nanismul hipofizar este utilizarea hormonului de creștere uman, deoarece apariția majorității cazurilor de nanism depinde, fără îndoială, de una sau alta formă de deficit al acestuia. Datorită specificității specifice a acestui hormon, doar somatotropina umană și primată este activă pentru oameni. Un medicament izolat din glanda pituitară a persoanelor care au decedat din cauza bolilor non-infecțioase și non-neoplazice este utilizat pe scară largă în clinică. Somatotropina umană este obținută prin sinteză bacteriană folosind Escherichia coli prin inginerie genetică. Somatotropina umană este, de asemenea, sintetizată chimic, dar este extrem de scumpă și practic nu este utilizată în clinică. Pacienții cu deficit dovedit de hormon de creștere endogen, cu diferențiere scheletică care nu depășește nivelul tipic pentru vârsta de 13-14 ani, sunt selectați pentru tratamentul cu somatotropină. Nu există restricții de vârstă pentru tratament.
Dozele minime eficiente care pot fi utilizate în prima perioadă de tratament sunt de 0,03-0,06 mg/kg greutate corporală. Dozele cele mai eficiente sunt de 2-4 mg de 3 ori pe săptămână. Creșterea dozei unice la 10 mg nu a fost însoțită de o creștere adecvată a efectului de creștere, dar a cauzat formarea rapidă de anticorpi împotriva somatotropinei.
În țara noastră, studiile privind studiul hormonului de creștere uman se desfășoară încă din anul 1960. Au fost testate două scheme de tratament: continuu și intermitent, cu cure de 2-3 luni și aceleași intervale între ele. Creșterea medie în înălțime a pacienților în primul an de tratament a fost de 9,52±0,39 cm, creșterea în greutate corporală a fost de 4,4±0,14 kg. În cazul tratamentului continuu pe termen lung, creșterea medie în înălțime a fost de 0,82 cm/lună, greutatea corporală - 0,38 kg/lună; în cazul tratamentului intermitent - 0,75 cm/lună și respectiv 0,4 kg/lună. Tratamentul continuu a asigurat o creștere mai rapidă în înălțime, cu o scădere bruscă a efectului după 1-1,5 ani, în timp ce în cazul tratamentului intermitent, eficacitatea s-a menținut timp de 3-4 ani, ceea ce ne permite să considerăm schema de tratament mai potrivită. Determinarea nivelului de IGF-I (somatomedină C) poate servi ca un indicator fiabil al sensibilității pacientului la tratamentul cu medicamente somatotropinice. O creștere a conținutului de IGF-I după introducerea hormonului somatotrop permite prezicerea unui efect pozitiv al terapiei. Un avantaj important al tratamentului cu somatotropină este absența accelerării osificării scheletice pe fondul acesteia.
Cel mai important mijloc de tratare a nanismului este utilizarea steroizilor anabolizanți, care stimulează creșterea prin creșterea sintezei proteinelor și a nivelului de hormon somatotrop endogen. Tratamentul se desfășoară timp de mai mulți ani, cu înlocuirea treptată a unor medicamente cu altele, de la compuși mai puțin activi la cei mai activi. Schimbarea medicamentelor anabolizante este indicată atunci când efectul de creștere scade după 2-3 ani, ceea ce duce la o creștere suplimentară a creșterii. Tratamentul se efectuează în cure (perioada de odihnă trebuie să fie jumătate din perioada de tratament). În caz de dependență, sunt indicate și pauze mai lungi (până la 4-6 luni). Se prescrie doar unul dintre steroizii anabolizanți la un moment dat. Combinarea a 2 sau mai multe medicamente este inadecvată, deoarece aceasta nu sporește efectele lor metabolice și de creștere. Acestea din urmă depind în primul rând de vârsta pacienților și de gradul de diferențiere a oaselor scheletice la începutul tratamentului. Cel mai bun efect se observă la pacienții cu vârsta sub 16-18 ani, cu osificare scheletică care nu depășește nivelul caracteristic unui tânăr de 14 ani. Este recomandabil să începeți tratamentul imediat după diagnosticare, de obicei de la vârsta de 5-7 ani. Înainte de tratament, este necesar să se evite prescrierea de gonadotropine și hormoni sexuali, care, stimulând creșterea, accelerează simultan diferențierea scheletică. Principiul dozării steroizilor anabolizanți este de la dozele minime eficiente la cele care cresc treptat. Dozele recomandate pentru cele mai frecvente medicamente sunt: nerobol (metandrostenol, dianabol) - 0,1-0,15 mg per 1 kg greutate corporală pe zi, administrat oral; nerobolil (durabolin) - 1 mg per 1 kg greutate corporală pe lună, administrat intramuscular, doza lunară fiind administrată în 2-3 doze, respectiv, după 15 sau 10 zile; retabolil (deca-durabolin) - 1 mg per 1 kg greutate corporală o dată pe lună, administrat intramuscular. Depășirea dozelor specificate poate duce la androgenizare. În doze fiziologice, acești compuși nu afectează semnificativ starea organelor genitale și diferențierea oaselor scheletice, ceea ce permite utilizarea lor pentru o perioadă lungă de timp la pacienții de ambele sexe. Fetele ar trebui să fie sub supravegherea unui ginecolog, deoarece în caz de supradozaj sau sensibilitate individuală crescută, unele paciente pot dezvolta semne de virilizare, care regresează rapid la întreruperea tratamentului. Medicamentele orale metilate până la etilate în poziția 17 pot provoca uneori un efect colestatic, prin urmare, în bolile hepatice, trebuie acordată preferință compușilor anabolizanți parenterali sau medicamentele orale trebuie combinate cu agenți coleretici. Foarte rar, tratamentul cu steroizi anabolizanți poate provoca reacții alergice (mâncărime, erupții cutanate). În absența complicațiilor, steroizii anabolizanți sunt utilizați atâta timp cât se observă efectul de creștere (până la 16-18 ani și uneori mai mult). Tratamentul se efectuează pe fondul terapiei generale de întărire.
Dacă pacienții prezintă semne de hipotiroidism, medicamentele tiroidiene (tiroxină, tiroidină, tirotom) sunt prescrise simultan în doze selectate individual.
În tratamentul băieților, următorul pas este administrarea de gonadotropină corionică umană. Acest medicament se utilizează nu mai devreme de 15-16 ani și adesea la o vârstă chiar mai târzie pentru a stimula celulele Leydig, ceea ce accelerează atât dezvoltarea sexuală, cât și creșterea (datorită activității anabolice a propriilor androgeni). Doze de 1000 până la 1500 UI se utilizează de 1-2 ori pe săptămână intramuscular, în cure de 2 luni, de maximum 2-3 ori pe an. Dacă efectul este incomplet, tratamentul cu gonadotropină corionică umană la băieții cu vârsta de 16 ani și peste se alternează cu administrarea de doze mici de androgeni (metiltestosteron în doză de 5-10 mg/zi, sublingual).
Fetele cu vârsta peste 16 ani pot începe tratamentul cu doze mici de estrogeni, simulând un ciclu sexual normal. Tratamentul se efectuează timp de 3 săptămâni în fiecare lună, urmat de o pauză. În a doua fază a ciclului, din a 3-a săptămână, se poate prescrie gonadotropină corionică în doză de 1000-1500 UI de 3-5 ori pe săptămână sau medicamente cu efect gestagenic (pregnină, progesteron).
Etapa finală a tratamentului (după închiderea zonelor de creștere) este administrarea constantă a dozelor terapeutice de hormoni sexuali corespunzătoare sexului pacientei, pentru a dezvolta complet organele genitale, caracteristicile sexuale secundare, a asigura libidoul și potența sexuală. Preparatele combinate estrogen-progestative (non-ovlon, bisecurină, infekundină, rigevidonă) sunt convenabile pentru tratarea pacientelor, iar preparatele androgenice cu eliberare prelungită (testenat, sustanon-250, omnadren-250) sunt convenabile pentru tratarea pacienților de sex masculin.
Se efectuează un tratament general de întărire (regim, dietă proteico-vegetariană, terapie cu vitamine, biostimulanți). Se indică utilizarea preparatelor de zinc, în mecanismul de acțiune al căror rol principal îl joacă creșterea activității IGF-1 (factorul de creștere asemănător insulinei I).
În prezența patologiei organice din sistemul nervos central, se administrează terapie antiinflamatorie, resorbtivă și pentru deshidratare. Terapia sistematică țintită are un efect încurajator. Ca urmare a tratamentului etapizat pe termen lung, 148 (80,4%) din 175 de pacienți cu nanism de ambele sexe au reușit să atingă o înălțime de peste 130 cm, 92 (52,5%) - peste 140 cm, iar 32 (18,3%) - 150-160 cm sau mai mult. În același timp, 37 de pacienți (21,2%) și-au mărit înălțimea cu 30 cm, 107 (61,1%) cu 31-50 cm, iar 31 (17,7%) cu 51-60 cm sau mai mult.
Prognoză
Prognosticul depinde de forma de nanism. În tipurile genetice de nanism, prognosticul pe viață este favorabil. În prezența unei tumori hipofizare și a leziunilor organice ale sistemului nervos central, aceasta este determinată de dinamica dezvoltării procesului patologic principal. Metodele moderne de terapie au crescut semnificativ capacitățile fizice și capacitatea de muncă a pacienților și le-au prelungit speranța de viață. În perioada de tratament activ, pacienții trebuie examinați de un medic la fiecare 2-3 luni, iar terapia de întreținere - la fiecare 6-12 luni.
Angajarea pacienților care corespunde capacităților lor intelectuale și fizice este de o importanță capitală pentru adaptarea lor socială.
Este recomandabil să alegeți profesii care nu sunt asociate cu efort fizic intens, dar vă permit să demonstrați abilități intelectuale, capacitatea de a efectua lucrări precise și limbi străine.


 [
[