Expert medical al articolului
Noile publicații
Meningita criptococică
Ultima examinare: 12.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
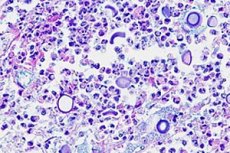
Inflamația meningelui poate fi cauzată nu numai de bacterii, virusuri și protiști, ci și de infecții fungice. Meningita criptococică este cauzată de drojdia încapsulată Cryptococcus neoformans, care este un agent patogen oportunist pentru oameni. [ 1 ] A fost numită boala Busse-Buschke datorită primei sale descrieri de către Otto Busse și Abraham Buschke în 1894. [ 2 ]
Conform ICD-10, codul bolii este G02.1 (în secțiunea despre boli inflamatorii ale sistemului nervos central) și, de asemenea, B45.1 în secțiunea despre micoze (adică boli fungice).
Epidemiologie
Opt din zece cazuri de meningită criptococică apar la persoane infectate cu HIV/SIDA.
Conform datelor publicate în revista The Lancet Infectious Diseases în primăvara anului 2017, ciuperca provoacă aproximativ 220.000 de cazuri de meningită criptococică în fiecare an în rândul persoanelor cu HIV sau SIDA, iar peste 180.000 decese. Majoritatea cazurilor de meningită criptococică apar în Africa Subsahariană.
Conform statisticilor OMS, în 2017, în Africa au fost înregistrate 165,8 mii de cazuri de meningită criptococică, 43,2 mii în țările asiatice, 9,7 mii în America de Nord și de Sud și 4,4 mii de cazuri ale bolii în țările europene.
Cauze meningită criptococică
Cauzele acestui tip de meningită sunt infecția cu ciuperca Cryptococcus neoformans (clasa Tremellomycetes, genul Filobasidiella), care trăiește în mediu: în sol (inclusiv praf), pe lemn în descompunere, în excrementele păsărilor (porumbeilor) și liliecilor etc. Infecția are loc pe cale aeriană - prin inhalarea aerosolilor de basidiospori ai ciupercii, deși la majoritatea persoanelor cu imunitate suficientă la dezvoltarea bolii, C. neoformans nu conduce și rămâne un microorganism oportunist intracelular facultativ (care nu poate infecta alte persoane). Citește și - Criptococii - agenți cauzatori ai criptococozei [ 3 ]
De regulă, meningita criptococică se dezvoltă la persoanele infectate cu HIV (în stadiul IVB) – ca infecție secundară, precum și la persoanele cu un sistem imunitar deficitar în alte boli însoțite de imunosupresie pe termen lung. [ 4 ]
Meningita criptococică este considerată o formă cerebrală sau extrapulmonară de criptococoză, care se dezvoltă după diseminarea hematogenă a C. neoformans din tractul respirator și plămâni către creier și măduva spinării.[ 5 ]
Factori de risc
Factorii care cresc riscul de a dezvolta meningită criptococică includ:
- perioada neonatală (perioada nou-născuților) și prematuritatea sugarilor;
- slăbirea sistemului imunitar în bolile oncologice (inclusiv leucemie, melanom multiplu, limfosarcom), la pacienții cu infecție cu HIV și SIDA;
- diabet;
- hepatită virală și alte boli cu complexe imune;
- anemie falciformă;
- chimioterapie în prezența unui diagnostic oncologic;
- depășirea nivelului admis de radiații ionizante;
- cure lungi de tratament cu antibiotice sau steroizi;
- instalarea de catetere și șunturi intravasculare;
- transplant de măduvă osoasă sau de organe interne.
Patogeneza
Criptococii, protejați de celulele imune umane de o capsulă de polizaharidă (care inhibă fagocitoza), secretă proteaze, urează, fosfolipază și nuclează – enzime capabile să distrugă celulele gazdă. [ 6 ]
Iar patogeneza criptococozei constă în faptul că aceste enzime deteriorează celulele prin liza membranelor, modificarea moleculelor, perturbarea funcțiilor organitelor celulare și modificarea citoscheletului. [ 7 ]
Serina proteazele fungice distrug legăturile peptidice ale proteinelor celulare, scindează imunoglobulinele și proteinele celulelor efectoare imune, iar replicarea C. neoformans are loc în fagocitele mononucleare (macrofage), ceea ce facilitează răspândirea acestora. [ 8 ]
În plus, prin trecerea prin celulele endoteliale și prin transportul în interiorul macrofagelor infectate, criptococii perturbă integritatea barierei hematoencefalice (BHE). Ciuperca se răspândește prin fluxul sanguin în lichidul cefalorahidian și apoi în membranele moi ale creierului, formând „colonii” de celule fungice în țesutul cerebral sub formă de pseudochisturi gelatinoase. [ 9 ]
Simptome meningită criptococică
Primele semne ale meningitei criptococice sunt febra (creșterea temperaturii până la +38,5-39°C) și durerile de cap severe.
Simptomele clinice includ, de asemenea, greață și vărsături, convulsii, rigiditate a gâtului, sensibilitate crescută a ochilor la lumină și tulburări de conștiență și comportament. [ 10 ]
După cum notează experții, dezvoltarea sindromului meningeal este mai lentă decât în cazul infecției bacteriene a meningelui.
Complicații și consecințe
Complicațiile și consecințele meningitei fungice cauzate de criptococ sunt:
- creștere semnificativă a presiunii intracraniene;
- leziuni izolate ale nervilor cranieni cu pareze/paralizie a nervului facial și modificări atrofice ale nervului optic (ducând la probleme oftalmologice);
- răspândirea procesului inflamator la țesuturile subcortexului și emisferele creierului - meningoencefalită criptococică;
- dezvoltarea abcesului cerebral (criptococom);
- revărsare în spațiul subdural (sub dura mater a creierului);
- leziuni ale măduvei spinării;
- modificări mentale și diminuarea funcțiilor cognitive.
Diagnostice meningită criptococică
Pe lângă istoricul medical și examenul fizic, diagnosticul infecției cu C. neoformans în meningită include în mod necesar analize de sânge: clinice generale și biochimice, analiza serului sanguin pentru anticorpi împotriva proteinelor C. neoformans și hemocultura.
Se efectuează o puncție lombară șise analizează lichidul cefalorahidian pentru antigen și se efectuează o analiză bacterioscopică (cultură bacteriană) a lichidului cefalorahidian. [ 11 ]
Diagnosticul instrumental se efectuează prin radiografie toracică și imagistică prin rezonanță magnetică a creierului.
Diagnostic diferentiat
Diagnosticul diferențial include meningita și meningoencefalita de etiologie bacteriană și virală, leziunile cerebrale cauzate de ciupercile Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatidis sau amoebe (inclusiv Naegleria fowleri).
Tratament meningită criptococică
Tratamentul etiologic are ca scop eradicarea criptococilor, pentru care se utilizează medicamente antifungice.
Schema de tratament include administrarea intravenoasă (perfuzie, prin cateter venos central sau perfuzie peritoneală) a antibioticului antifungic polienic Amfotericină B (Amphocyl) în combinație cu medicamentul antifungic Flucitozină (5-fluorocitozină) sau Fluconazol, care are efect fungicid și fungistatic. Dozajul acestor medicamente se calculează în funcție de greutatea corporală a pacientului.
Monitorizarea constantă a stării pacientului este necesară, deoarece Amfotericina B are un efect toxic asupra rinichilor, iar efectele secundare ale Flucitozinei pot include suprimarea funcției hematopoietice a măduvei osoase, stop respirator sau cardiac, dezvoltarea leziunilor cutanate sub formă de necroliză epidermică etc.
Conform recomandărilor publicate în actualizarea IDSA (Societatea Americană de Boli Infecțioase) din 2010, tratamentul nu s-a schimbat de zece ani. Tratamentul antifungic de primă linie se bazează pe inducție, consolidare și menținere la următoarele trei tipuri de pacienți: [ 12 ]
Boli legate de HIV
- Terapia de inducție
- Deoxicolat de amfotericină B (0,7-1,0 mg/kg/zi) + flucitozină (100 mg/kg/zi oral) timp de 2 săptămâni (Dovadă A1)
- Amfotericină B liposomală (3-4 mg/kg/zi) sau complex lipidic amfotericină B (5 mg/kg/zi; se monitorizează funcția renală) + flucitozină (100 mg/kg/zi) timp de 2 săptămâni (Dovadă B2)
- Deoxicolat de amfotericină B (0,7 până la 1,0 mg/kg/zi) sau amfotericină B liposomală (3 până la 4 mg/kg/zi) sau complex lipidic de amfotericină B (5 mg/kg/zi, pentru pacienții care nu tolerează flucitozina) timp de 4 până la 6 săptămâni (Dovadă B2)
- Alternative la terapia de inducție
- Deoxicolat de amfotericină B + fluconazol (Dovadă B1)
- Fluconazol + flucitozină (Dovadă B2)
- Fluconazol (Dovadă B2)
- Itraconazol (Dovadă C2)
- Fluconazol (400 mg/zi) timp de 8 săptămâni (Date A1)
- Fluconazol (200 mg/zi) timp de 1 an sau mai mult (Dovadă A1)
- Itraconazol (400 mg/zi) timp de 1 an sau mai mult (Evident C1)
- Deoxicolat de amfotericină B (1 mg/kg/săptămână) timp de 1 an sau mai mult (Dovadă C1)
- Terapia de consolidare
- Terapie de susținere
- Alternative la terapia de întreținere
Boli legate de transplant
- Terapia de inducție
- Amfotericină B liposomală (3-4 mg/kg/zi) sau complex lipidic amfotericină B (5 mg/kg/zi) + flucitozină (100 mg/kg/zi) timp de 2 săptămâni (Dovadă B3)
- Alternative la terapia de inducție
- Amfotericină B liposomală (6 mg/kg/zi) sau complex lipidic amfotericină B (5 mg/kg/zi) timp de 4-6 săptămâni (Dovadă B3)
- Deoxicolat de amfotericină B (0,7 mg/kg/zi) timp de 4-6 săptămâni (Dovadă B3)
- Fluconazol (400 până la 800 mg/zi) timp de 8 săptămâni (Dovadă B3)
- Fluconazol (200 până la 400 mg/zi) timp de 6 luni până la 1 an (Dovadă B3)
- Terapia de consolidare
- Terapie de susținere
Boli non-HIV/transplant
- Terapia de inducție
- Deoxicolat de amfotericină B (0,7 până la 1,0 mg/kg/zi) + flucitozină (100 mg/kg/zi) timp de 4 sau mai multe săptămâni (Dovadă B2)
- Deoxicolat de amfotericină B (0,7–1,0 mg/kg/zi) timp de 6 săptămâni (Dovadă B2)
- Amfotericină B liposomală (3-4 mg/kg/zi) sau complex lipidic amfotericină B (5 mg/kg/zi) în combinație cu flucitozină, 4 săptămâni (Dovadă B3)
- Deoxicolat de amfotericină B (0,7 mg/kg/zi) + flucitozină (100 mg/kg/zi) timp de 2 săptămâni (Dovadă B2)
- Terapia de consolidare
- Fluconazol (400 până la 800 mg/zi) timp de 8 săptămâni (Dovadă B3)
- Fluconazol (200 mg/zi) timp de 6-12 luni (Dovadă B3)
- Terapie de susținere
Combinația de amfotericină B și flucitozină s-a dovedit a fi cea mai eficientă în eliminarea infecției și a demonstrat un beneficiu mai mare în ceea ce privește supraviețuirea decât amfotericina administrată singură. Cu toate acestea, din cauza costului său, flucitozina este adesea indisponibilă în mediile cu resurse limitate, unde povara bolii este mare. Combinațiile de amfotericină B și fluconazol au fost studiate și au arătat rezultate superioare în comparație cu amfotericina B administrată singură.[ 13 ], [ 14 ], [ 15 ]
Fără tratament, evoluția clinică progresează spre confuzie, convulsii, scăderea nivelului de conștiență și comă.
Cefaleea refractară la analgezice poate fi tratată prin decompresie spinală după o evaluare neuroimagistică adecvată cu CT sau RMN. Volumul maxim sigur de LCR care poate fi drenat cu o singură puncție lombară este neclar, dar adesea se elimină până la 30 ml, verificându-se presiunea după fiecare 10 ml de prelevare.[ 16 ]
Profilaxie
Prevenirea infecției cu ciuperca Cryptococcus neoformans este necesară, în primul rând, în cazurile unui sistem imunitar slăbit. [ 17 ] Se recomandă evitarea locurilor cu praf și a lucrului cu pământ, iar persoanele infectate cu HIV ar trebui să primească terapie antiretrovirală continuă.
Prognoză
Fără tratament, prognosticul oricărei meningite fungice este slab.
Prognosticul inițial depinde de predictori ai mortalității, cum ar fi următorii [ 18 ], [ 19 ]:
- Presiunea de deschidere a lichidului cefalorahidian este mai mare de 25 cm H2O.
- Număr scăzut de leucocite în lichidul cefalorahidian
- Deficiență senzorială
- Diagnostic tardiv
- Titruri crescute de antigen în lichidul cefalorahidian
- Rata de eliminare a infecției
- Cantitatea de drojdie din LCR depășește 10 mm3 ( practică obișnuită în Brazilia) [ 20 ]
- Pacienți fără legătură cu HIV și factori prognostici la acești pacienți, pe lângă cei deja menționați:
- Markeri ai unui răspuns inflamator slab
- Fără dureri de cap
- Malignitate hematologică primară
- Boală cronică de rinichi sau ficat
Mortalitatea variază de la o țară la alta, în funcție de resursele disponibile. Aceasta rămâne ridicată în Statele Unite și Franța, cu rate ale mortalității la 10 săptămâni cuprinse între 15% și 26% și chiar mai mari la pacienții neinfectați cu HIV, din cauza diagnosticării tardive și a răspunsurilor imune disfuncționale. Pe de altă parte, în țările cu resurse reduse, mortalitatea crește de la 30% la 70% la 10 săptămâni din cauza prezentării tardive și a lipsei de acces la medicamente, tensiometre și monitorizare optimă.

