Rabia la copii
Last reviewed: 24.06.2018

Avem reguli stricte de aprovizionare și oferim linkuri doar către site-uri medicale reputate, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale evaluate de colegi. Rețineți că numerele din paranteze ([1], [2] etc.) sunt linkuri către aceste studii pe care se poate da clic.
Dacă considerați că vreunul dintre conținuturile noastre este inexact, învechit sau altfel discutabil, vă rugăm să îl selectați și să apăsați Ctrl + Enter.
Rabia, sau hidrofobia, este o boală virală acută transmisă prin mușcătura unui animal infectat, cu afectarea sistemului nervos și dezvoltarea unei encefalite severe cu rezultat fatal.
Un flagel pentru sănătatea publică încă din cele mai vechi timpuri, virusul rabiei provoacă în prezent aproximativ 59.000 de decese umane în fiecare an, aproape toate fiind transmise prin mușcături de câine. Acest lucru are un impact economic semnificativ asupra țărilor în curs de dezvoltare, în special în Africa și Asia, care pot suporta cele mai mici astfel de pierderi. Cu toate acestea, în ciuda ratei sale de mortalitate de aproape 100%, rabia canină este o boală complet prevenibilă, iar exemplele istorice de eradicare a rabiei canine în lumea dezvoltată atestă acest lucru. [ 1 ]
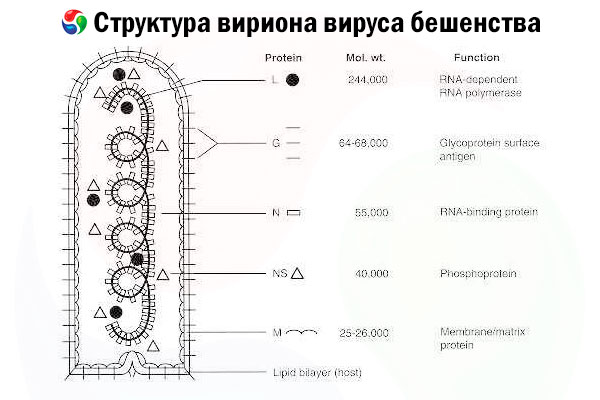
Agentul cauzal este virusul rabiei (RV), un virus cu ARN cu catenă negativă din familia rhabdovirusurilor, cu o dimensiune de aproximativ 60 nm × 180 nm.
Este alcătuită dintr-un miez proteic intern, sau nucleocapsidă, care conține acid nucleic, și o membrană externă, un bistrat care conține lipide și este acoperit cu spicule glicoproteice transmembranare. Are o structură modulară a genomului relativ simplă și codifică cinci proteine structurale:
- ARN polimerază ARN dependentă de ARN (L),
- nucleoproteină (N),
- proteina fosforilată (P),
- proteina matriceală (M) și
- glicoproteina (G) de pe suprafața exterioară.
Proteinele N, P și L, împreună cu ARN-ul genomic, formează complexul ribonucleoproteic. G este singurul antigen RV capabil să inducă producerea de anticorpi neutralizanți RV, care sunt principalii efectori imuni împotriva infecției letale cu RV. Pe de altă parte, s-a demonstrat că complexul ribonucleoproteic este principalul antigen RV capabil să inducă celule T CD4+, care pot spori producția de anticorpi neutralizanți RV prin recunoașterea intrastructurală a antigenului.[ 2 ] Complexul ribonucleoproteic poate juca un rol important în stabilirea memoriei imunologice și a imunității pe termen lung.[ 3 ]
Clasificare și tipuri de antigene
Genul Lyssavirus include virusul rabiei și virusuri rabice înrudite antigenic și genetic: virusurile de lilieci Lagos, Mokola și Duvenhage, precum și două subtipuri presupuse de lisavirusuri de lilieci europeni. Studiile de protecție încrucișată indică faptul că animalele imunizate cu vaccinuri tradiționale antirabice pot să nu fie complet protejate atunci când sunt expuse la alte lisavirusuri.
Virusurile rabice pot fi clasificate ca fixe (adaptate prin trecerea în animale sau culturi celulare) sau virale (tip sălbatic). Utilizarea anticorpilor monoclonali și a secvențierii genetice pentru a diferenția virusurile rabice virale a ajutat la identificarea variantelor virale provenite din principalele rezervoare gazdă din întreaga lume și la sugerarea unor surse probabile de expunere umană atunci când, în cazul unui pacient, antecedentele unei mușcături de animal definitive erau absente.[ 8 ]
Principalul rezervor și sursă de infecție în rândul animalelor sălbatice sunt lupii, vulpile, șacalii, liliecii, iar în rândul animalelor domestice - câinii și pisicile, rareori - caii, bovinele, porcii, șobolanii etc. Transmiterea infecției de la persoană la persoană, deși posibilă, este extrem de rară. Aceasta este o infecție zoonotică tipică. Oamenii se infectează cu rabie în principal de la câini.
După ce un om este mușcat de un animal bolnav, virusul se înmulțește în țesutul muscular de la locul mușcăturii, apoi, ajungând la capetele nervilor periferici senzoriali, se răspândește centripet, ajungând la neuronii motori. Timpul necesar virusului pentru a se deplasa și a afecta creierul depinde de locul mușcăturii. În cazul mușcăturilor severe ale capului și feței, virusul poate ajunge la sistemul nervos central în 15-20 de zile, iar în cazul unor leziuni minore ale pielii trunchiului și membrelor și, în consecință, al unei doze mici de agent patogen, procesul de deplasare a virusului către sistemul nervos central poate fi întârziat cu câteva luni sau chiar până la 1-1,5 ani. După ce a ajuns la sistemul nervos central, virusul se fixează în țesuturile creierului și măduvei spinării, în principal în neuronii rahidianului, cornul lui Amon și baza creierului. În măduva spinării, coarnele posterioare sunt cele mai afectate. Din sistemul nervos central, virusul ajunge centrifug de-a lungul trunchiurilor nervoase la glandele salivare, unde se înmulțește și este excretat cu saliva.
Concepte în patogeneza rabiei
RV are o gamă largă de gazde și poate infecta aproape toate mamiferele. Deși au fost raportate mai multe căi de transmitere a RV, infecția naturală are loc cel mai frecvent prin mușcătură. Pe lângă mușcături, consumul carcaselor infectate cu RV poate favoriza infecția cu virusul rabic la vulpile arctice, iar contactul RV cu membranele mucoase s-a dovedit a fi o altă posibilă cale de transmitere.[ 9 ] În unele circumstanțe neobișnuite, cum ar fi eliberarea accidentală a RV sub formă de aerosol într-un laborator sau a RV sub formă de aerosol în peșteri locuite de un număr mare de lilieci,[ 10 ] poate avea loc transmiterea prin aerosoli.
Nu este încă clar dacă tulpinile de RV de stradă și cele adaptate la șoareci sau la culturi tisulare se replică la locul inoculării înainte de a intra în SNC. În timp ce infecția intramusculară experimentală a hamsterilor sau ratonilor juvenili cu RV de stradă a relevat replicarea RV în celulele musculare striate înainte ca virusul să invadeze axonii neuronilor motori prin joncțiunile neuromusculare,[ 11 ],[ 12 ] infecția intramusculară a șoarecilor cu RV CVS-24 adaptat la șoareci a arătat că RV migrează direct către SNC fără replicare prealabilă la locul inoculării.[ 13 ] Odată ajuns în terminalele axonilor nemielinizați, RV este transportat retrograd către corpul celular.
Descoperiri recente sugerează că transportul veziculelor axonale ar putea reprezenta o strategie cheie pentru mișcarea virionilor pe distanțe lungi în axoni.[ 14 ] S-a estimat că RV migrează în interiorul axonilor cu o rată de 3 mm/h.[ 15 ] Infecția se răspândește apoi printr-un lanț de neuroni conectați prin joncțiuni sinaptice. Cu toate acestea, mecanismul exact care promovează răspândirea transsinaptică este încă necunoscut. După infectarea creierului, virusul se răspândește centrifugal către sistemul nervos periferic și autonom în multe organe periferice.[ 16 ] În ultima etapă a ciclului de infecție, RV migrează către glandele salivare; după replicarea în celulele acinare mucogene, este eliberat în salivă și este gata pentru transmiterea către următoarea gazdă.[ 17 ]
În ceea ce privește patologia indusă de virusul rabiei, moartea celulară apoptotică a fost propusă ca un potențial mecanism patogen în modelele experimentale de rabie la șoareci infectați cu o tulpină fixă de RV.[ 18 ] Un mecanism patogen care poate contribui la disfuncția profundă a SNC caracteristică rabiei poate fi afectarea funcției neuronale. S-a demonstrat că expresia genelor este semnificativ redusă în neuronii infectați cu RV, rezultând o suprimare generală a sintezei proteinelor,[ 19 ] iar mai multe studii au arătat o neurotransmisie afectată după infecția cu RV. Jiang a demonstrat că legarea unui antagonist al receptorilor de acetilcolină la homogenatele cerebrale de șobolan infectat a fost redusă în comparație cu grupul de control.[ 20 ] Eliberarea și legarea afectate a serotoninei, un neurotransmițător implicat în controlul ciclului de somn, percepției durerii și comportamentului, au fost observate și în creierul de șobolan infectat cu RV. [ 21 ], [ 22 ] Pe lângă afectarea neurotransmisiei, infecția ventriculară dreaptă poate afecta și canalele ionice. Celulele de neuroblastom murin infectate prezintă o expresie funcțională scăzută a canalelor de sodiu voltaj-dependente, ceea ce poate preveni potențialele de acțiune și, în cele din urmă, poate duce la afectare funcțională. [ 23 ]
Pe lângă absența leziunilor patologice grave la nivelul SNC, majoritatea cazurilor de rabie umană nu provoacă un răspuns imun la 7 până la 10 zile de la apariția semnelor clinice. Aceste diferențe profunde între patogeneza rabiei și cea a majorității celorlalte infecții virale sau bacteriene ale SNC sunt susținute și de faptul că imunosupresia este fie ineficientă, fie dăunătoare pentru rezultatul rabiei.[ 24 ] Nivelul scăzut de răspuns imun observat adesea la victimele rabiei este derutant, deoarece nu poate fi explicat prin imunogenitatea slabă a antigenelor RV. De fapt, proteina G a RV și proteina nucleocapsidică sunt antigene puternice ale celulelor B și T atunci când sunt administrate parenteral. [ 25 ] O posibilă explicație pentru gradul scăzut de răspuns imun împotriva RV la oameni sau animale cu rabie ar putea fi faptul că infecția SNC cu RV provoacă imunosupresie [ 26 ] și s-a propus că RV folosește o strategie subversivă, inclusiv prevenirea apoptozei și distrugerea celulelor T invadatoare. [ 27 ]
Tulpinile de RV atenuate care au fost adaptate la celule non-neuronale diferă semnificativ de tulpinile de RV patogene de stradă prin neuroinvazivitatea lor, care se referă la capacitatea lor de a invada SNC din locuri periferice. În acest sens, tulpinile de RV adaptate la culturi tisulare fie nu au, fie au doar o capacitate limitată de a invada SNC din locuri periferice, în timp ce tulpinile de RV de stradă sau tulpinile de RV adaptate la șoareci, cum ar fi CVS-24, sunt extrem de invazive.[ 28 ] Factorii cheie implicați în neuroinvazia RV includ absorbția virală, transportul axonal, răspândirea transsinaptică și rata de replicare virală.
Până de curând, cunoștințele noastre despre patogeneza RV erau limitate și se bazau în principal pe studii descriptive ale tulpinilor de RV de pe străzi sau pe infecții experimentale cu tulpini atenuate adaptate în laborator. Apariția tehnologiei geneticii inverse ne-a permis să identificăm elementele virale care determină fenotipul patogen al RV și să înțelegem mai bine mecanismele implicate în patogeneza rabiei.
Identificarea elementelor virale care controlează achiziția, diseminarea și replicarea virusului rabic
- Elemente virale implicate în capturarea virusului
Infecția cu RV începe prin atașarea virusului la un presupus receptor celular. Deși mai multe molecule de suprafață a membranei au fost propuse ca receptori ai RV, inclusiv receptorul nicotinic de acetilcolină,[ 29 ] molecula de adeziune a celulelor neuronale[ 30 ] și receptorul de neurotrofină p75 NTR cu afinitate scăzută,[ 31 ] încă nu este clar dacă aceste molecule joacă de fapt un rol în ciclul de viață al virusului rabic. În acest context, s-a demonstrat recent că interacțiunea RV G-p75 NTR nu este necesară pentru infecția neuronilor primari cu RV.[ 32 ] După legarea receptorului, RV este internalizat prin endocitoză adsorbtivă sau mediată de receptori.[ 33 ] Mediul cu pH scăzut din compartimentul endosomal induce apoi modificări conformaționale în RV G care declanșează fuziunea membranei virale cu membrana endosomală, eliberând astfel RNP în citoplasmă.[ 34 ] Pentru virusuri, RV G joacă un rol critic în absorbția virală, cel mai probabil prin interacțiuni cu presupuși receptori celulari care facilitează absorbția rapidă. În acest sens, s-a demonstrat că patogenitatea tulpinilor de RV adaptate la culturi tisulare (de exemplu, ERA, HEP și CVS-11) se corelează cu prezența unui determinant situat în situsul antigenic III al proteinei G. [ 35 ] O mutație Arg → Gln la poziția 333 în acest situs antigenic al proteinei G ERA a dus la o întârziere de șapte ori în internalizarea variantei de RV Gln333 în comparație cu varianta de tip sălbatic. Mutația Asn194→Lys194 în RV G, care explică reapariția fenotipului patogen, a fost asociată cu o scădere semnificativă a timpului de internalizare.[ 36 ] În plus, experimentele cu RV himerici au arătat că timpul necesar pentru internalizarea virionilor RV a crescut semnificativ, iar patogenitatea a fost redusă puternic în urma înlocuirii genei G a tulpinii SB de RV înalt patogene, care a fost derivată dintr-o clonă ADNc a tulpinii RV-18 asociate cu liliecii derivate din argint,[ 37 ] cu cea a tulpinii SN înalt atenuate, care a fost izolată dintr-o clonă ADNc a tulpinii vaccinale SAD B19 RV.[ 38 ] Împreună, aceste date susțin ideea că cinetica absorbției virusului, care este o funcție a RV G, este un factor determinant major al patogenității RV.
- Elemente virale implicate în răspândirea și transmiterea virusurilor
O proprietate unică a virusului rabic este capacitatea sa de a se răspândi de la o celulă la alta. Observația că varianta Gln333 ERA pierde activitatea de fuziune celulă-celulă dependentă de pH in vitro [ 39 ] și prezintă o capacitate mult redusă de a se răspândi de la o celulă la alta [ 40 ] sugerează că RV G joacă, de asemenea, un rol cheie în răspândirea de la o celulă la alta și, prin urmare, în transmiterea virusului, probabil prin activitatea sa fusiogenică. Această posibilitate este susținută în continuare de constatarea că rata de răspândire a SPBNGAK revertant patogen la RV este de aproape două ori mai mare decât cea determinată pentru varianta SPBNGA nepatogenă. Interesant este că mutația Asn 194 → Lys 194 în G SPBNGAK a cauzat o modificare a pragului de pH pentru fuziunea membranară la un pH mai mare, susținând ipoteza că un prag de pH mai mare pentru fuziunea membranară este asociat cu o răspândire crescută a virusului. [ 41 ]
Studiile indicatorilor transneuronali ai infecției cu RV la șobolani [ 42 ] și maimuțe rhesus [ 43 ] au arătat că virusul rabiei migrează exclusiv în direcție retrogradă în axoni. Deși mai multe proteine ale RV sunt implicate în mecanismele de transport neuronal, RV G pare să joace un rol predominant în răspândirea transneuronală a infecției cu RV. De exemplu, în timp ce infecția periferică cu virusul anemiei infecțioase ecvine (EIAV) pseudotipizat cu RV G are ca rezultat transferul viral în măduva spinării, același EIAV pseudotipizat cu virusul stomatitei veziculare G nu a reușit să pătrundă în sistemul nervos. [ 44 ] În plus, s-a constatat că răspândirea virală a mutantului ERA G Arg 333 → Gln 333 în SNC este puternic redusă în comparație cu mutantul de tip sălbatic, sugerând în continuare o funcție a RV G intact în răspândirea transsinaptică. Cu toate acestea, cea mai convingătoare dovadă a unui rol important al RV G în transportul transsinaptic provine din infecția intracraniană a șoarecilor cu un virus RV recombinant cu deficit de G, care a arătat că infecția a rămas limitată la neuronii de la locul inoculării, fără nicio dovadă de răspândire la neuronii secundari.[ 45 ] Cu toate acestea, este probabil ca, pe lângă RV G, RV M să joace și un rol în răspândirea virusului și, prin urmare, în transportul transsinaptic. În acest sens, s-a demonstrat că răspândirea variantei himerice SN-BMBG a RV, care conține atât M, cât și G din SB, extrem de patogen, a fost semnificativ mai mare decât răspândirea variantei himerice SN-BG sau SN-BM, care conțin G și, respectiv, M din SB, sugerând că interacțiunea optimă a M cu G poate juca un rol important în răspândirea virusului de la celulă la celulă. [ 46 ] Întrucât RV M susține înmugurirea virusului, [ 47 ] este probabil ca răspândirea mai eficientă a variantei himerice SN-BMBG a RV să se datoreze înmuguririi optime a virusului la nivelul membranei postsinaptice.
Studii recente au arătat că interacțiunea dintre proteina P a RV și lanțul ușor al dineinei leagă proteina RNP a RV de sistemul de transport al celulei gazdă, facilitând astfel transportul axonal retrograd al virusului.[ 48 ],[ 49 ] Cu toate acestea, infecția periferică a șoarecilor adulți a arătat că ștergerea domeniului de legare LC8 al proteinei P a RV nu împiedică intrarea virusului în SNC, sugerând că proteina RV nu este implicată direct în răspândirea axonală retrogradă a RV.[ 50 ]
- Elemente virale care controlează replicarea virală
Spre deosebire de multe alte virusuri, cum ar fi virusul gripal, patogenitatea RV este invers proporțională cu rata de sinteză a ARN-ului viral și cu producerea de particule virale infecțioase. Compararea nivelurilor de ARNm viral și ARN genomic produse de diferite virusuri himerice sugerează că transcripția și replicarea ARN-ului viral sunt reglate de mai mulți factori, inclusiv M al RV, care a fost identificat ca un factor transactiv ce mediază trecerea de la niveluri inițiale ridicate de sinteză a ARN-ului la sinteza ARN-ului genomic.[ 51 ] În plus, M de la toate rabdovirusurile este capabil să oprească exprimarea genelor virale prin legarea la RNP, rezultând formarea unei structuri foarte condensate, asemănătoare unei coloane vertebrale, care nu este capabilă să susțină sinteza ARN-ului.
Pentru a identifica alte elemente virale care controlează patogenitatea prin reglarea replicării virale, secvențele terminale 5' ale tulpinii SB înalt patogene au fost înlocuite treptat cu secvențe din tulpina vaccinală SN înalt atenuată, rezultând virusurile recombinante SB2 (secvență terminală [TS] + L), SB3 (TS + L + pseudogena [Ψ]), SB4 (TS + L + Ψ + G) și SB5 (TS + L + Ψ + G + M). Infecția intramusculară cu virusurile parentale SB și SN și RV-urile himerice SB2, SB3, SB4 și SB5 a provocat cele mai mari rate de mortalitate la șoarecii infectați cu SB și nicio morbiditate sau mortalitate la șoarecii infectați cu SN. Înlocuirea TS, L și SB cu elementele corespunzătoare din SN a dus la o reducere modestă a morbidității și mortalității, iar un schimb suplimentar de G sau G plus M a redus puternic sau a abolit complet patogenitatea virală.
Caracterizarea fenotipică a acestor RV de tip sălbatic și himerice în culturi de țesuturi a relevat că patogenitatea unui anumit RV este invers corelată cu capacitatea sa de a se replica în celulele neuronale. Deși SB s-a replicat la niveluri de aproape 1000 de ori mai mici decât SN, iar înlocuirea TS, L și din SB cu nivelurile de SN a avut un efect redus asupra cineticii creșterii virale, înlocuirea suplimentară a G sau G plus M din SB cu genele SN corespunzătoare a dus la o creștere de 1 log a producției de virus, sugerând că cinetica de replicare a ARN-ului viral, precum și producția de particule virale sunt în mare măsură controlate de proteina G a RV. Această concluzie este susținută de datele obținute cu variante G de RV care diferă printr-un aminoacid în proteinele lor G. Varianta patogenă a virusului rabic SPBNGAK 194 a produs un titru viral în celulele NA cu 1 log mai mic decât cel produs de varianta nepatogenă SPBNGAN 194, iar analiza PCR în timp real a arătat că ratele de transcripție și replicare a ARN-ului viral în celulele NA infectate cu SPBNGAK au fost de 5 și 10 ori mai mari decât în celulele NA infectate cu SPBNGAK.[ 52 ] Dovezi suplimentare pentru o corelație inversă între patogenitate și rata de sinteză a ARN-ului viral și producerea de particule virale au fost furnizate de șoarecii infectați cu virusuri recombinante himerice în care genele G și M ale tulpinii SN atenuate au fost înlocuite cu cele ale tulpinii SB înalt patogene. Aceste experimente au relevat o creștere semnificativă a patogenității tulpinii SN parentale purtătoare a genei G a RV față de tulpina SB patogenă. Patogenitatea a crescut și mai mult atunci când atât G, cât și M din SB au fost introduse în SN.
Substituirea lui G sau M sau a ambelor în SN cu genele corespunzătoare din SB a fost asociată cu o scădere semnificativă a ratei de producție a particulelor virale, precum și a ratei de sinteză a ARN-ului viral. Aceste date indică faptul că atât G, cât și M joacă roluri importante în patogeneza RV prin reglarea replicării virale. Constatările conform cărora substituirea lui G sau G plus M în SN cu G sau G plus M din SB au ca rezultat o scădere moderată până la puternică a transcripției și replicării ARN-ului viral, respectiv, în timp ce substituirea lui M singur în SN cu M din SB are ca rezultat o creștere puternică a transcripției și replicării ARN-ului viral, indică faptul că gena G din RV are, de asemenea, o funcție de reglare importantă în transcripția/replicarea ARN-ului viral, fie singură, fie prin interacțiunea cu proteina M. Mecanismul prin care gena G din RV controlează sinteza ARN-ului viral este necunoscut. Anumite secvențe de nucleotide din cadrul genelor G din RV, cum ar fi cele care includ codonii pentru Arg333 și Lys 194, au fost identificate ca ținte pentru microARN-urile celulare. S-a demonstrat că recunoașterea țintei de către microARN-urile celulare poate duce la reglarea pozitivă sau negativă a replicării virale. [ 53 ] Substituțiile Arg 333 → Glu 333 sau Lys 194 → Ser 194 în secvența genei G a RV duc la abolirea secvențelor țintă ale microARN-urilor, ceea ce, la rândul său, este asociat cu o creștere semnificativă a ratei de sinteză a ARN-ului viral [Faber M, Universitatea Thomas Jefferson, PA, SUA, Date nepublicate], sugerând că microARN-urile celulare gazdă joacă, de asemenea, un rol important în reglarea replicării RV, așa cum s-a demonstrat și pentru alte virusuri ARN, inclusiv virusul stomatitei veziculare și HCV. [ 54 ], [ 55 ]
Reglarea replicării virale pare a fi unul dintre mecanismele importante implicate în patogeneza RV. Pentru a evita răspunsul imun și a păstra integritatea rețelei neuronale, tulpinile patogene de RV, dar nu și tulpinile atenuate, își pot regla rata de creștere. O rată de replicare mai mică este probabil benefică pentru tulpinile patogene de RV prin conservarea structurii neuronale pe care aceste virusuri o utilizează pentru a ajunge la SNC. O altă explicație pentru rata de replicare mai mică a RV patogene este că, pentru a evita detectarea timpurie de către sistemul imunitar al gazdei, virusul menține niveluri minime de exprimare a antigenelor sale.
Relația dintre expresia RV G, apoptoză și patogenitate
Este bine cunoscut faptul că tulpinile virusului rabic stradal, semnificativ mai patogene decât tulpinile adaptate la culturi tisulare, exprimă niveluri foarte limitate de G și nu induc apoptoză decât târziu în ciclul infecțios, ceea ce sugerează că patogenitatea unei anumite tulpini virale este invers corelată cu expresia G a RV și cu capacitatea de a induce apoptoza.[ 56 ] Dovezi directe pentru o corelație între nivelul de expresie G și gradul de apoptoză au fost obținute cu RV SPBNGA-GA recombinant, care purta două gene G identice și supraexprima RV G.[ 57 ] Studiile morfologice ale culturilor neuronale infectate cu acest RV recombinant au arătat că moartea celulară a fost semnificativ crescută în paralel cu supraexprimarea G a RV și că apoptoza este principalul mecanism implicat în moartea mediată de G a RV. În special, scăderea colorației cu F-actina după infecția cu SPBNGA-GA este în concordanță cu depolimerizarea filamentelor de actină indusă de apoptoză. În plus, numărul de nuclei TUNEL-pozitivi în neuronii infectați cu SPBNGA-GA a fost semnificativ crescut în comparație cu cel din neuronii neinfectați și infectați cu SPBNGA. Cu toate acestea, mecanismul prin care gena RV G mediază procesul de semnalizare apoptotică rămâne în mare parte necunoscut. S-a sugerat că expresia RV G peste un anumit prag perturbă grav membrana celulară. Este foarte probabil ca celulele apoptotice să nu fie eliminate rapid în SNC și, prin urmare, să sufere necroză secundară. [ 58 ] Pe de altă parte, infecția cu RV și, în special, supraexprimarea proteinei RV G poate duce la piroptoză, o cale de moarte celulară similară cu apoptoza care, spre deosebire de apoptoză, implică activarea caspazei 1 și, prin urmare, duce la necroză. [ 59 ] Gradul de necroză sau piroptoză indusă de infecția cu RV joacă probabil un rol critic în inducerea imunității antivirale. În timp ce celulele apoptotice își mențin integritatea membranei și nu stimulează răspunsul imun înnăscut, celulele necrotice devin permeabilizate și secretă adjuvanți endogeni care pot declanșa un răspuns imun înnăscut robust. [ 60 ]
Întrucât nivelul de apoptoză/necroză se corelează cu imunogenitatea RV, s-a sugerat că efectul imunostimulator al celulelor apoptotice/necrotice contribuie cel mai probabil la generarea unui răspuns imun protector. Prin urmare, reglarea expresiei G a RV este foarte probabil un factor important în patogeneza rabiei, deoarece oferă un mijloc pentru supraviețuirea și diseminarea variantelor patogene de RV în sistemul nervos fără a provoca leziuni neuronale evidente și declanșând un răspuns imun protector care ar preveni infecția.
Expresia proteinei G a RV poate fi reglată la nivelul sintezei ARN-ului, la nivel post-translațional sau la ambele. S-a demonstrat că nivelurile de proteine G a RV exprimate de diferite variante himerice ale RV sunt reflectate de rata de sinteză a ARN-ului viral, sugerând că reglarea diferențială a expresiei proteinei G a RV de către aceste variante rezultă din variațiile ratei de transcripție a ARN-ului viral. Ca și în cazul ratelor de transcripție a ARN-ului viral, cantitatea de proteine G a RV exprimată de aceste variante se corelează invers cu patogenitatea virală. Pe de altă parte, infectarea culturilor neuronale primare cu varianta RV mai puțin patogenă CVS-B2c a dus la niveluri de patru ori mai mari de proteină G decât infecția cu varianta înalt patogenă CVS-N2c, în ciuda sintezei unor niveluri comparabile de ARNm G în ambele infecții. Experimentele pulse-chase au arătat că nivelurile mai ridicate de proteină G în neuronii infectați cu CVS-B2c au fost în mare măsură rezultatul unei rate mai mici de degradare a proteinei G CVS-B2c în comparație cu proteina G CVS-N2c. Cu toate acestea, mecanismul care duce la degradarea proteolitică mai rapidă a proteinei G CVS-N2c rămâne de elucidat.
Perioada de incubație pentru rabie este în medie de 30-90 de zile. În cazul unei infecții masive prin răni mari ale capului și feței, aceasta poate fi scurtată la 12 zile. În cazuri rare, perioada de incubație poate dura 1 an sau mai mult.
Există o schimbare strict secvențială a trei perioade ale bolii: prodromală, excitație, paralizie.
Perioada prodromală începe cu apariția durerii dureroase sau tractoare la locul mușcăturii, precum și a durerii de-a lungul nervilor. În zona cicatricei, poate exista o senzație de arsură, mâncărime, uneori roșeață și umflături. Pacientul prezintă stare generală de rău, dureri de cap, greață. Se observă vărsături, o creștere a temperaturii corpului la 37,5-38 °C și simptome ale unei tulburări mintale progresive: excitabilitate reflexă crescută, un sentiment inexplicabil de anxietate, frică, melancolie. Adesea, pacientul este deprimat, inhibat, retras, refuză să mănânce, doarme prost, se plânge de gânduri sumbre, vise înspăimântătoare. Perioada prodromală durează 2-3 zile, uneori se extinde până la 7 zile. La sfârșitul acestei perioade, pot exista atacuri de anxietate cu dificultăți de respirație pe termen scurt, o senzație de apăsare în piept, însoțite de tahicardie și creșterea frecvenței respiratorii.
Perioada de excitație este marcată de apariția hidrofobiei: atunci când încearcă să bea, iar apoi la vederea apei sau la amintirea acesteia, pacientul experimentează un spasm convulsiv al faringelui și laringelui, timp în care aruncă cana cu apă cu un țipăt, aruncă mâinile tremurânde înainte, își dă capul și corpul pe spate. Gâtul este întins, o grimasă dureroasă distorsionează fața, care devine albăstruie din cauza unui spasm al mușchilor respiratori. Ochii se umflă, exprimă frică, imploră ajutor, pupilele sunt dilatate, inhalarea este dificilă. În punctul culminant al atacului, este posibil stopul cardiac și respirator. Atacul durează câteva secunde, după care starea pacientului pare să se îmbunătățească. Ulterior, pot apărea atacuri de spasme ale mușchilor laringelui și faringelui chiar și din cauza mișcării aerului (aerofobie), a luminii puternice (fotofobie) sau a unui cuvânt rostit tare (acusticofobie). Atacurile sunt însoțite de agitație psihomotorie, timp în care pacientul se comportă ca un „nebun”. Conștiența este încețoșată în timpul atacului, dar se liniștește în perioada interictală. În perioada de agitație, din cauza tonusului crescut al sistemului nervos simpatic, pacienții prezintă o creștere bruscă a salivației (sialoree) cu incapacitatea de a înghiți saliva din cauza spasmului mușchilor faringieni. Pacientul pulverizează salivă. Unii pacienți pot dezvolta semne de meningism și chiar opistotonus, iar convulsiile sunt frecvente. În acest caz, lichidul cefalorahidian poate să nu se modifice, dar la unii pacienți, concentrația de proteine poate crește și numărul de celule poate crește datorită limfocitelor.
Fără un tratament adecvat, semnele de deshidratare se intensifică, trăsăturile faciale devin mai accentuate, iar greutatea corporală scade. Temperatura corpului crește la valori ridicate. Sunt posibile convulsii. Durata etapei de excitație este de aproximativ 2-3 zile, rareori 4-5 zile. Un rezultat fatal apare de obicei în timpul unuia dintre atacuri. Rareori, pacientul supraviețuiește până la a treia etapă a bolii.
În perioada de paralizie, pacientul se calmează. Atacurile de hidrofobie încetează, pacientul poate bea și înghiți alimente, conștiința este clară. Cu toate acestea, în ciuda stării aparente de bine, letargia, apatia, depresia se intensifică, apar rapid paralizii ale membrelor, tulburări pelvine, paralizie a nervilor cranieni. Temperatura corpului crește la 42-43 °C, tensiunea arterială scade, iar până la sfârșitul primei zile survine moartea din cauza paraliziei centrilor cardiovascular și respirator.
În sângele periferic se observă leucocitoză neutrofilă, creșterea hemoglobinei, a eritrocitelor și a hematocritului.
Ce te deranjează?
Clinic, se disting formele tipice și atipice. Formele atipice includ toate cazurile fără excitație și hidrofobie. Formele atipice includ bulbare, cerebeloase, meningoencefalitice etc.
Detectarea antigenului rabic, a anticorpilor, a ARN-ului viral sau izolarea virusului permite diagnosticarea rabiei. Deoarece orice test individual poate fi negativ la un pacient cu rabie, uneori sunt necesare probe seriale de ser pentru detectarea anticorpilor antirabici, probe de salivă pentru cultura virală și biopsie cutanată pentru testarea imunofluorescenței directe pentru antigenul viral, în special atunci când se suspectează rabia.
Una dintre cele mai rapide metode de diagnosticare a rabiei antemortem la om este efectuarea unui test de imunofluorescență directă pe o biopsie cutanată de la ceafă pentru a detecta antigenul rabic. Testul de imunofluorescență directă este cea mai sensibilă și specifică metodă pentru detectarea antigenului rabic în piele și în alte țesuturi proaspete (de exemplu, biopsia cerebrală), deși rezultatele pot fi ocazional negative la începutul bolii. Dacă țesutul proaspăt nu este disponibil, digestia enzimatică a țesuturilor fixate poate crește reactivitatea testului de imunofluorescență; cu toate acestea, sensibilitatea poate fi inacceptabil de scăzută.
Diagnosticul poate fi stabilit și dacă virusul este izolat din salivă după inocularea celulelor de neuroblastom sau a rozătoarelor de laborator; aceasta este de obicei cea mai eficientă în primele 2-3 săptămâni de boală. Detectarea anticorpilor neutralizanți ai virusului rabiei, efectuată de obicei prin testul rapid de inhibare a focalizării fluorescente (RFFIT), în serul persoanelor nevaccinate este, de asemenea, diagnostică. Prezența anticorpilor în lichidul cefalorahidian confirmă diagnosticul, dar aceștia pot apărea cu 2-3 zile mai târziu decât anticorpii serici și, prin urmare, pot fi mai puțin utili în stadiile incipiente ale bolii. Deși răspunsul serologic după vaccinare este, în general, imposibil de distins de răspunsul serologic indus de boală, vaccinarea nu produce de obicei anticorpi împotriva lichidului cefalorahidian.
Doar șapte cazuri de „recuperare” după rabie în ultimii 25 de ani au fost bine documentate. Deși virusul rabic nu a fost izolat de la niciunul dintre pacienți, titrurile ridicate de anticorpi neutralizanți antirabici din probele de ser și prezența anticorpilor neutralizanți în lichidul cefalorahidian au susținut puternic diagnosticul.
Ce trebuie să examinăm?
Ce teste sunt necesare?
Diagnosticul rabiei umane se pune de obicei pe baza datelor epidemiologice și clinice și se confirmă în laborator. Diagnosticul este simplu dacă există antecedente de mușcături de animale și dacă s-a manifestat întregul spectru de simptome și semne. În caz contrar, este necesară o evaluare atentă, dar rapidă, a caracteristicilor epidemiologice și clinice ale cazurilor mai puțin tipice înainte de efectuarea unor teste de laborator specifice. Orice pacient cu semne sau simptome neurologice sau encefalită inexplicabilă trebuie întrebat despre posibilitatea expunerii la animale din zonele endemice pentru rabie, din interiorul sau din afara țării de reședință. Eșecul de a suspecta rabia în cazul mai multor decese umane recente din Statele Unite s-ar putea datora lipsei unui istoric atent al expunerii.
La debutul bolii, rabia poate imita multe boli infecțioase și neinfecțioase. Multe alte encefalite, cum ar fi cele cauzate de herpesvirusuri și arbovirusuri, seamănă cu rabia. Alte boli infecțioase pot, de asemenea, imita rabia, cum ar fi tetanosul, malaria cerebrală, rickettsioza și febra tifoidă. Bolile infecțioase paralitice care pot fi confundate cu rabia includ poliomielita, botulismul și encefalita simiană B cu herpes.
Bolile neinfecțioase care pot fi confundate cu rabia includ o serie de sindroame neurologice, în special polineuropatia inflamatorie acută (sindromul Guillain-Barré), precum și encefalomielita alergică postvaccinală secundară vaccinării antirabice a țesutului nervos, otrăvirii sau intoxicației medicamentoase, sevrajului alcoolic, porfiriei acute și isteriei rabice. Sindromul Guillain-Barré poate fi confundat cu rabia paralitică și invers.
Tratamentul pentru rabie nu a fost dezvoltat. Administrarea de doze mari de imunoglobulină antirabică specifică și interferon leucocitar este ineficientă. Se administrează tratament simptomatic pentru a ameliora suferința pacientului. În acest scop, pacientul este plasat într-o secție sau o boxă separată, se creează un regim de protecție care limitează influența mediului extern (zgomot redus, lumină puternică, flux de aer). Pentru a reduce excitabilitatea sistemului nervos central, se prescriu somnifere, anticonvulsivante și analgezice. Bilanțul hidric este normalizat.
În stadiul paralitic, se prescriu medicamente care stimulează activitatea sistemelor cardiovascular și respirator. Se recomandă utilizarea oxigenării hiperbarice, a hipotermiei cerebrale, a respirației mecanice controlate cu curarizarea completă a pacientului. Cu toate acestea, toate metodele de tratament sunt practic ineficiente. În cel mai bun caz, este posibilă prelungirea vieții pacientului cu câteva luni. Un rezultat nefavorabil este predeterminat de severitatea afectării trunchiului cerebral cu distrugerea centrilor vitali.
Dezvoltarea primului vaccin antirabic de către Pasteur în 1885 a inaugurat o eră a controlului mult mai eficient al rabiei. Astăzi, în ciuda ratei mortalității de aproape 100% la om din cauza rabiei, boala este complet prevenibilă prin vaccinare pre- și/sau post-expunere. În timp ce Pasteur și colegii săi au inițiat vaccinarea câinilor din mediul privat la Paris, prima vaccinare în masă a câinilor a fost efectuată la începutul anilor 1920 în Japonia, marcând primul program național major de control al rabiei. Vaccinarea orală a animalelor sălbatice, dezvoltată pentru prima dată în anii 1970, s-a dovedit în mod repetat că controlează eficient boala la gazdele terestre majore, cum ar fi vulpile, ratonii și sconcșii.[ 68 ] Vaccinarea susținută antirabică a populațiilor de animale rezervor la rate de acoperire de 70% sau mai mari va elimina în cele din urmă RABV de la speciile rezervor și va preveni răspândirea virusului la gazdele incidentale.[ 69 ]
Datele filogenetice indică faptul că lisavirusurile au infectat liliecii cu mult înainte de a infecta mamiferele terestre, iar majoritatea lisavirusurilor, inclusiv RABV, circulă încă la diverse specii de lilieci din întreaga lume.[ 70 ] Cu toate acestea, metodele eficiente de prevenire a transmiterii RABV între lilieci rămân evazive, excluzând posibilitatea eradicării complete a rabiei în acest moment. Cu toate acestea, chiar și după expunerea la RABV prin mușcătura unui mamifer infectat cu rabie, profilaxia post-expunere sigură și eficientă (PEP, inclusiv curățarea rănilor, imunoglobulină antirabică și vaccinare antirabică) poate proteja oamenii de infecția cu rabie dacă tratamentul este administrat prompt și conform recomandărilor Organizației Mondiale a Sănătății (OMS).
Aceste două metode de prevenire a deceselor umane – una bazată pe vaccinarea persoanelor expuse și cealaltă pe vaccinarea unui număr suficient de câini pentru a rupe ciclul transmiterii la sursă – reprezintă elementele constitutive ale unei abordări „o singură sănătate” pentru prevenirea și controlul rabiei canine. Aceste două mijloace diferite de prevenire a deceselor umane au fost luate în considerare ca alternative separate: Strategia A, bazată pe furnizarea de PEP oamenilor, și Strategia B, bazată pe vaccinarea câinilor; sau ca componente ale unei Strategii combinate A + B într-o analiză a costurilor probabile ale strategiilor alternative.[ 71 ]
Țări precum Thailanda au avut un succes enorm în prevenirea deceselor umane prin utilizarea PEP, dar au constatat și o cerere tot mai mare și costuri asociate cu utilizarea exclusivă a PEP. [ 72 ] De exemplu, comparativ cu situația din 1991, de patru ori mai multe persoane (peste 400.000) aveau nevoie de PEP în 2003. Date recente arată că Republica Populară Chineză, care vaccinează 15 milioane de oameni pe an după o potențială expunere la rabie, cheltuiește aproximativ 650 de milioane de dolari americani pe an numai pentru PEP. [ 73 ]
O abordare mult mai sustenabilă este prevenirea răspândirii infecției la sursă, în populația animală, crescând în același timp accesul la PEP pentru pacienții umani expuși, atunci când este necesar. Acolo unde există voință politică și finanțare adecvată pentru a controla rabia canină, decesele pot fi eliminate și au fost eliminate. Utilizarea pe scară largă a vaccinării câinilor a dus la eliminarea rabiei canine din mai multe țări, inclusiv Malaezia în 1954, [ 74 ] Japonia în 1956, Taiwan în 1961, Singapore și, în special, în întreaga Europă de Vest (revizuit în Rupprecht și colab., King și colab. și Gongal și Wright). [ 75 ]

 [
[