Expert medical al articolului
Noile publicații
Virusul imunodeficienței umane (HIV)
Ultima examinare: 04.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Sindromul imunodeficienței dobândite a fost identificat ca o boală specifică în 1981 în Statele Unite, când un număr de tineri au dezvoltat boli grave cauzate de microorganisme care erau nepatogene sau slab patogene pentru persoanele sănătoase. Un studiu al stării imune a pacienților a relevat o scădere bruscă a numărului de limfocite în general și de limfocite T-helper în special. Această afecțiune a fost numită SIDA (Sindromul Imunodeficienței Dobândite). Metoda de infectare (contact sexual, prin sânge și preparate ale acestuia) a indicat natura infecțioasă a bolii.
Agentul cauzator al SIDA a fost descoperit în 1983 independent de francezul L. Montagnier, care l-a numit virusul asociat limfoadenopatiei LAV, deoarece l-a găsit la un pacient cu limfadenopatie; și de americanul R. Gallo, care a numit virusul HTLV-III (Virus limfotropic T uman III): acesta descoperise anterior virusurile limfotropice I și II.
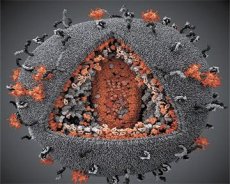
O comparație a proprietăților virusurilor LAV și HTLV-III a demonstrat identitatea acestora, așa că, pentru a evita confuzia, virusul a fost denumit HIV (Virusul Imunodeficienței Umane sau HIV) în 1986. HIV are o formă sferică, cu un diametru de 110 nm. Învelișul viral are forma unui poliedru, compus din 12 pentagoane și 20 de hexagoane. În centrul și în colțurile fiecărui hexagon se află o moleculă de proteină glicozilată gpl20 (numărul 120 indică greutatea moleculară a proteinei în kilodaltoni). Un total de 72 de molecule de gpl20 sunt situate pe suprafața virionului sub formă de vârfuri specifice, fiecare dintre acestea fiind asociat cu proteina intramembranară gp41. Aceste proteine, împreună cu stratul dublu lipidic, formează supercapsida (membrana) virionului.
Proteinele gpl20 și gp41 se formează prin tăierea proteinei precursoare Env de către o protează celulară. Proteina gp41 formează „tulpina” spiculoasă prin legarea cu domeniul său citoplasmatic de proteina matriceală p17MA situată direct sub anvelopă. Moleculele p17 interacționează în timpul maturării virionului pentru a forma un icosaedru care stă la baza anvelopei.
În partea centrală a virionului, proteina p24 formează o capsidă în formă de con. Partea îngustată a capsidei este conectată la membrana virionului cu participarea proteinei rb. În interiorul capsidei se află două molecule identice de ARN genomic viral. Acestea sunt conectate prin capetele lor 5' la proteina nucleocapsidică p7NC. Această proteină este interesantă deoarece are două reziduuri de aminoacizi (motive) bogate în cisteină și histidină și care conțin un atom de Zn - sunt numite „degete de zinc” deoarece captează molecule de ARN genomic pentru includerea în virionii care se formează. Capsida conține, de asemenea, trei enzime. Revertaza (RT), sau complexul pol, include transcriptaza inversă, RNază H și ADN polimerază dependentă de ADN. Revertaza este prezentă ca heterodimer p66/p51. Proteaza (PR) - p10, inițiază și implementează procesul de maturare a virionului. Integraza (IN) - p31, sau endonucleaza, asigură includerea ADN-ului proviral în genomul celulei gazdă. Capsida conține, de asemenea, o moleculă de ARN primer (tRNAl"3).
Genomul ARN din celulă este convertit într-un genom ADN (provirus ADN) cu ajutorul transcriptazei inverse, format din 9283 de perechi de nucleotide. Acesta este delimitat la stânga și la dreapta de așa-numitele repetiții terminale lungi, sau LTR: S'-LTR la stânga și 3'-LTR la dreapta. LTR-urile conțin câte 638 de perechi de nucleotide fiecare.
Genomul HIV este alcătuit din 9 gene, dintre care unele se suprapun la capete (au mai multe cadre de citire) și au o structură exonintronică. Acestea controlează sinteza a 9 proteine structurale și 6 proteine reglatoare.
Importanța LTR-urilor pentru genomul viral constă în faptul că acestea conțin următoarele elemente de reglare care controlează funcționarea acestuia:
- semnal de transcripție (regiunea promotorului);
- semnal de adiție poli-A;
- semnal de plafonare;
- semnal de integrare;
- semnal de reglare pozitiv (TAR pentru proteina TAT);
- element reglator negativ (NRE pentru proteina NEF);
- un situs pentru atașarea ARN-ului primer (tRNA™3) pentru sinteza ADN-ului cu catenă minus la capătul 3'; un semnal la capătul 5' al LTR care servește ca primer pentru sinteza ADN-ului cu catenă plus.
În plus, LTR conține elemente implicate în reglarea splicingului ARNm, ambalarea moleculelor de ARNv în capsidă (elementul Psi). În cele din urmă, în timpul transcripției genomului, în ARNm lungi se formează două semnale pentru proteina REV, care comută sinteza proteinelor: CAR - pentru proteinele reglatoare și CRS - pentru proteinele structurale. Dacă proteina REV se leagă de CAR, se sintetizează proteine structurale; dacă aceasta lipsește, se sintetizează doar proteine reglatoare.
Următoarele gene reglatoare și proteinele acestora joacă un rol deosebit de important în reglarea funcționării genomului viral:
- Proteina TAT, care efectuează controlul pozitiv al replicării virale și acționează prin regiunea de reglare TAR;
- Proteinele NEV și VPU, care exercită un control negativ al replicării prin regiunea NRE;
- Proteina REV, care efectuează controlul pozitiv-negativ. Proteina REV controlează activitatea genelor gag, pol, env și efectuează reglarea negativă a splicingului.
Astfel, replicarea HIV este sub control triplu - pozitiv, negativ și pozitiv-negativ.
Proteina VIF determină infecțiozitatea virusului nou sintetizat. Aceasta este asociată cu proteina capsidei p24 și este prezentă în virion în cantitate de 60 de molecule. Proteina NEF este reprezentată în virion de un număr mic de molecule (5-10), posibil asociate cu anvelopa.
Proteina VPR inhibă ciclul celular în faza G2, participă la transportul complexelor de preintegrare în nucleul celular, activează unele gene virale și celulare și crește eficiența replicării virusului în monocite și macrofage. Localizarea proteinelor VPR, TAT, REV și VPU în virion nu a fost stabilită.
Pe lângă proteinele proprii, membrana virionului poate conține și unele proteine ale celulei gazdă. Proteinele VPU și VPR participă la reglarea reproducerii virale.
Variante antigenice ale virusului imunodeficienței umane (HIV)
Virusul imunodeficienței umane (HIV) este foarte variabil. Chiar și din corpul unui singur pacient, pot fi izolate tulpini virale care diferă semnificativ în ceea ce privește proprietățile antigenice. Această variabilitate este facilitată de distrugerea intensivă a celulelor CD4+ și de un răspuns puternic al anticorpilor la infecția cu HIV. O nouă formă de HIV, HIV-2, biologic apropiată de HIV-1, dar imunologic diferită de acesta, a fost izolată de la pacienți din Africa de Vest. Omologia structurii primare a genomurilor acestor virusuri este de 42%. Provirusul ADN HIV-2 conține 9671 pb, iar LTR-ul său - 854 pb. HIV-2 a fost ulterior izolat în alte regiuni ale lumii. Nu există imunitate încrucișată între HIV-1 și HIV-2. Sunt cunoscute două forme mari de HIV-1: O (Outlier) și M (Major), aceasta din urmă fiind împărțită în 10 subtipuri (AJ). Opt subtipuri (AH) circulă în Rusia.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mecanismul de interacțiune al HIV-ului cu celula
După ce pătrunde în organism, virusul atacă mai întâi celulele care conțin receptorul CD4 specific acestuia. Acest receptor este prezent în cantități mari în receptorii T-helperi, în cantități mai mici în macrofage și monocite, iar receptorii T-helperi sunt deosebit de sensibili la virus.
Virusul imunodeficienței umane (HIV) recunoaște receptorii CD4 folosind proteina sa gpl20. Procesul de interacțiune a HIV cu celula are loc conform următoarei scheme: adsorbție mediată de receptor -> veziculă acoperită -> veziculă acoperită -> lizozom. În aceasta, membrana virionului fuzionează cu membrana lizozomului, iar nucleocapsida, eliberată din supercapsidă, intră în citoplasmă; în drum spre nucleu, este distrusă, iar ARN-ul genomic și componentele centrale asociate sunt eliberate. Apoi, transcriptaza inversă sintetizează catena minus de ADN de pe ARN-ul virionului, apoi RNaza H distruge ARN-ul virionului, iar ADN polimeraza virală sintetizează catena plus de ADN. 5'-LTR și 3'-LTR se formează la capetele provirusului ADN. Provirusul ADN poate rămâne în nucleu o perioadă de timp într-o formă inactivă, dar mai devreme sau mai târziu este integrat în cromozomul celulei țintă cu ajutorul integrazei sale. În cadrul acesteia, provirusul rămâne inactiv până când limfocitul T respectiv este activat de antigeni microbieni sau de alte celule imunocompetente. Activarea transcripției ADN-ului celular este reglată de un factor nuclear special (NF-kB). Este o proteină care leagă ADN-ul și este produsă în cantități mari în timpul activării și proliferării limfocitelor T și monocitelor. Această proteină se leagă de anumite secvențe de ADN celular și de secvențe LTR similare ale provirusului ADN și induce transcripția atât a ADN-ului celular, cât și a provirusului ADN. Prin inducerea transcripției provirusului ADN, se realizează tranziția virusului dintr-o stare inactivă într-una activă și, în consecință, dintr-o infecție persistentă într-una productivă. Provirusul poate rămâne într-o stare inactivă pentru o perioadă foarte lungă de timp. Activarea virusului este un moment critic în interacțiunea sa cu celula.
Din momentul în care virusul pătrunde în celulă, începe perioada de infecție cu HIV - starea de purtător al virusului, care poate dura 10 ani sau mai mult; iar din momentul în care virusul este activat, începe boala - SIDA. Cu ajutorul genelor sale reglatoare și al produselor acestora, virusul începe să se reproducă activ. Proteina TAT poate crește rata de reproducere a virusului de 1000 de ori. Transcripția virală este complexă. Aceasta include formarea atât a ARNm de lungime completă, cât și a celui subgenomic, splicing-ul ARNm, iar apoi are loc sinteza proteinelor structurale și reglatoare.
Sinteza proteinelor structurale are loc după cum urmează. Mai întâi, se sintetizează poliproteina precursoare Pr55Gag (o proteină cu o greutate moleculară de 55 kDa). Aceasta conține 4 domenii principale: matrice (MA), capsidă (CA), nucleocapsidă (NC) și domeniul rb, din care, ca urmare a tăierii Pr55Gag de către proteaza virală (este auto-tăiată dintr-o altă proteină precursoare, Gag-Pol), se formează proteinele structurale p17, p24, p7 și respectiv rb. Formarea poliproteinei Pr55Gag este principala condiție pentru formarea particulelor virale. Această proteină determină programul de morfogeneză a virionului. Aceasta include secvențial etapele de transport al poliproteinei Gag la membrana plasmatică, interacțiunea cu aceasta și interacțiunile proteină-proteină în timpul formării particulei virale și înmuguririi acesteia. Pr55Gag este sintetizat pe poliribozomi liberi; Moleculele de proteine sunt transportate la membrană, unde sunt ancorate de regiunile lor hidrofobe. Domeniul CA joacă rolul principal în crearea conformației native a proteinei Gag. Domeniul NC asigură includerea (cu ajutorul „degetelor sale de zinc”) a 2 molecule de ARN genomic în compoziția particulei virale în formare. Molecula poliproteică inițial dimerizează datorită interacțiunii domeniilor matriceale. Apoi, dimerii se combină în complexe hexamerice (de 6 unități) ca urmare a interacțiunii domeniilor CA și NC. În final, hexamerii, unindu-se la suprafețele lor laterale, formează virioni sferici imaturi, în interiorul cărora este conținut ARN-ul viral genomic, captat de domeniul NC.
O altă proteină precursoare, Prl60Gag-Pol (o proteină cu o greutate moleculară de 160 kDa), este sintetizată ca urmare a unei schimbări a cadrului de citire de către ribozom în timpul translației capătului 3' al genei gag în regiunea situată imediat în amonte de regiunea care codifică proteina rb. Această poliproteină Gag-Pol conține o secvență incompletă de proteină Gag (1-423 aminoacizi) și secvențe Pol care includ domeniile PR, RT și IN. Moleculele poliproteice Gag-Pol sunt, de asemenea, sintetizate pe poliribozomi liberi și sunt transportate la membrana plasmatică. Poliproteina Prl60Gagpol conține toate situsurile de interacțiune intermoleculară și situsurile de legare la membrană inerente poliproteinei Gag. Prin urmare, moleculele poliproteice Gag-Pol fuzionează cu membrana și, împreună cu moleculele Gag, sunt incluse în virionii în formare, rezultând apariția proteazei active și începutul procesului de maturare a virionului. Proteaza HIV-1 este extrem de activă doar sub formă de dimer, prin urmare, pentru autoexcizia sa din Prl60Gag-Pol, este necesară dimerizarea acestor molecule. Maturarea virionului constă în faptul că proteaza activă eliberată taie prl60Gag-Pol și Gag55 în locurile recunoscute de aceasta; se formează proteinele p17, p24, p7, p6, revertază, integrază și are loc asocierea lor în structura virală.
Proteina Env este sintetizată pe ribozomii asociați cu membranele reticulului endoplasmatic, apoi este glicozilată, secționată de o protează celulară în gp120 și gp41 și transportată la suprafața celulei. În acest caz, gp41 penetrează membrana și se leagă de domeniile matriceale ale moleculei proteice Gag asociate cu suprafața interioară a membranei. Această conexiune este păstrată în virionul matur.
Astfel, asamblarea particulelor virale constă în agregarea proteinelor precursoare și a moleculelor de ARN asociate pe membrana plasmatică a celulei gazdă, formarea virionilor imaturi și eliberarea acestora prin înmugurire de la suprafața celulară. În timpul înmuguririi, virionul se înconjoară cu o membrană celulară în care sunt încorporate moleculele gp41 și gp120. În timpul înmuguririi sau, eventual, după eliberarea virionilor, are loc maturarea acestora, care se realizează cu ajutorul unei proteaze virale și constă în tăierea proteolitică a proteinelor precursoare Pr55Gag și Prl60Gag-Pol în proteine ale virusului matur și asocierea lor în anumite complexe structurale. Rolul principal în procesele de morfogeneză virală îl joacă poliproteina precursoare Pr55Gag, care organizează și asamblează virionul imatur; procesul de maturare a acestuia este finalizat de o protează virală specifică.
Cauzele imunodeficienței
Una dintre principalele cauze ale imunodeficienței în infecția cu HIV este moartea în masă a celulelor T helper. Aceasta apare ca urmare a următoarelor evenimente. În primul rând, celulele T helper infectate cu virusul mor din cauza apoptozei. Se crede că la pacienții cu SIDA, replicarea virală, apoptoza și scăderea numărului de celule T helper sunt interconectate. În al doilea rând, celulele T killer recunosc și distrug celulele T infectate cu virusul sau care poartă molecule gpl20 adsorbite, precum și celulele T helper infectate cu virus și neinfectate cu virus, care formează simplaste (sincițiu) constând din câteva zeci de celule (unele dintre ele mor ca urmare a reproducerii virusurilor în ele). Ca urmare a distrugerii unui număr mare de T-helperi, există o scădere a expresiei receptorilor membranari din limfocitele B la interleukina-2, sinteza diferitelor interleukine (factori de creștere și diferențiere a limfocitelor B - IL-4, IL-5, IL-6 etc.) este perturbată, rezultând o perturbare a funcției sistemului T-killer. Activitatea sistemelor complement și macrofage este suprimată. Macrofagele și monocitele infectate cu virusul nu mor mult timp, dar nu sunt capabile să elimine virusul din organism. În cele din urmă, datorită similarității structurale și antigenice a gpl20 cu receptorii unor celule epiteliale ale organismului (inclusiv receptorii trofoblastici care mediază transmiterea HIV prin transplant), se sintetizează anticorpi antireceptori cu un spectru larg de acțiune. Astfel de anticorpi sunt capabili să blocheze diverși receptori celulari și să complice evoluția bolii cu tulburări autoimune. Consecința infecției cu HIV este înfrângerea tuturor verigilor principale ale sistemului imunitar. Acești pacienți devin lipsiți de apărare împotriva unei game largi de microorganisme. Aceasta duce la dezvoltarea infecțiilor oportuniste și a tumorilor. Pentru pacienții infectați cu HIV, riscul de a dezvolta cel puțin trei tipuri de cancer este crescut: sarcomul Kaposi; carcinomul (inclusiv cancerul de piele); limfomul cu celule B, care apare din cauza transformării maligne a limfocitelor B. Cu toate acestea, HIV nu este doar limfocitotrop, ci și neurotrop. Acesta pătrunde în celulele sistemului nervos central (astrocite) atât prin endocitoză mediată de receptori, cât și prin fagocitoza limfoblastelor infectate cu virus de către astrocite. Când virusul interacționează cu astrocitele, se formează și simplaste, care facilitează răspândirea agentului patogen prin canalele intercelulare. Virusul poate persista în macrofage și monocite pentru o lungă perioadă de timp, astfel încât acestea servesc drept rezervor și distribuitor al acestuia în organism, putând pătrunde în toate țesuturile. Macrofagele infectate joacă un rol major în introducerea HIV în sistemul nervos central și în deteriorarea acestuia. La 10% dintre pacienți, sindroamele clinice primare sunt asociate cu afectarea sistemului nervos central și se manifestă sub formă de demență. Astfel, persoanele infectate cu HIV sunt caracterizate prin 3 grupe de boli - infecții oportuniste,boli tumorale și leziuni ale sistemului nervos central.
Epidemiologia infecției cu HIV
Sursa infecției cu HIV este doar o persoană - o persoană bolnavă sau un purtător de virus. Virusul imunodeficienței umane (HIV) este conținut în sânge, spermă, lichid cervical; la mamele care alăptează - în laptele matern. Infecția are loc pe cale sexuală, prin sânge și preparate din acesta, precum și de la mamă la copil înainte, în timpul și după naștere. Nu se cunosc cazuri de infecție cu virusul prin alimente, băuturi și mușcături de insecte.
Dependența de droguri contribuie la răspândirea SIDA. Incidența HIV crește în fiecare an. Conform OMS, între 1980 și 2000, 58 de milioane de persoane au fost infectate cu HIV. Numai în anul 2000, 5,3 milioane de persoane au fost infectate la nivel mondial, iar 3 milioane de oameni au murit din cauza SIDA. La 1 ianuarie 2004, în Rusia erau înregistrate 264 de mii de persoane infectate cu HIV. Jumătate dintre persoanele infectate cu HIV mor în decurs de 11-12 ani de la momentul infectării. La începutul anului 2004, din fiecare 100 de mii de cetățeni ai Rusiei, aproximativ 180 trăiau cu diagnosticul de „infecție cu HIV”. Se preconizează că, cu acest nivel de morbiditate, numărul total de persoane infectate cu HIV în Rusia până în 2012 va fi de 2,5-3 milioane de persoane. Complexitatea luptei împotriva infecției cu HIV depinde de o serie de motive: în primul rând, nu există metode eficiente de tratament și prevenire specifică a acesteia; în al doilea rând, perioada de incubație pentru infecția cu HIV poate depăși 10 ani. Durata sa depinde de momentul activării limfocitului T și de provirusul ADN conținut în cromozomul său. Încă nu este clar dacă toți cei infectați cu virusul sunt sortiți SIDA sau dacă este posibilă transmiterea pe termen lung a virusului fără boală (ceea ce pare puțin probabil). În cele din urmă, există mai multe virusuri imunodeficienței umane (HIV-1, HIV-2), diferențele antigenice dintre care împiedică formarea imunității încrucișate. Descoperirea virusului imunodeficienței simiene (SIV) a aruncat lumină asupra problemei originii HIV. SIV este similar cu HIV în ceea ce privește organizarea genomului său, dar diferă semnificativ în ceea ce privește secvența sa de nucleotide. HIV-2 ocupă o poziție intermediară între HIV-1 și SIV în ceea ce privește proprietățile sale serologice și este mai apropiat de SIV în ceea ce privește secvența sa de nucleotide. În acest sens, V. M. Jdanov a sugerat că virusurile HIV-1, HIV-2 și SIV provin dintr-un strămoș comun. Este posibil, conform lui R. Gallo, ca unul dintre SIV-uri să fi pătruns cumva în corpul uman, unde a suferit o serie de mutații, rezultând în apariția HIV-1, HIV-2 și a celorlalte forme ale sale.
Simptomele infecției cu HIV
Virusul imunodeficienței umane are unele caracteristici care determină în mare măsură patogeneza bolii. Virusul are o rată de reproducere foarte mare, determinată de elementele sale reglatoare (până la 5.000 de virioni sunt sintetizați în 5 minute în stadiul activ). Datorită prezenței proteinei de fuziune (gp41), virusul induce formarea unor structuri sincițiale extinse datorită fuziunii T-helper-ilor infectați și neinfectați, ceea ce duce la moartea lor în masă. Moleculele de proteină gpl20 formate în cantități mari circulă liber în sânge și se leagă de receptorii T-helper-ilor neinfectați, drept urmare sunt, de asemenea, recunoscute și distruse de T-killere. Virusul se poate răspândi prin canale intercelulare de la celulă la celulă, caz în care devine puțin accesibil anticorpilor.
Criterii clinice pentru infecția cu HIV
La adulți, infecția cu HIV este diagnosticată atunci când aceștia prezintă cel puțin două simptome grave în combinație cu cel puțin un simptom minor și în absența altor cauze cunoscute de imunodeficiență (cancer, imunodeficiență congenitală, înfometare severă etc.). Simptomele grave includ:
- pierdere în greutate de 10% sau mai mult;
- o stare febrilă prelungită, intermitentă sau constantă;
- diaree cronică.
Simptome minore: tuse persistentă, dermatită generalizată, herpes zoster recurent, candidoză orală și faringiană, herpes simplex cronic, limfadenopatie generalizată. Diagnosticul de SIDA se pune doar în prezența sarcomului Kaposi, a meningitei criptococice, a pneumoniei cu pneumocystis. Tabloul clinic al bolii este influențat de infecția oportunistă însoțitoare.
Metode de cultivare a virusului imunodeficienței umane (HIV)
HIV-1 și HIV-2 pot fi cultivate în celulele unei singure clone de limfocite TCV4 - H9, obținută din limfocite TCV4 leucemice. Culturile monostrat de celule astrocitare, în care HIV-1 se reproduce bine, pot fi, de asemenea, utilizate în aceste scopuri. Cimpanzeii sunt sensibili la HIV-1 printre animale.
Rezistența virusului în mediul extern este scăzută. Acesta moare sub influența luminii solare și a radiațiilor UV, este distrus la 80 °C în 30 de minute, iar când este tratat cu dezinfectanți utilizați în mod obișnuit - în 20-30 de minute. Pentru a dezinfecta materialele care conțin virusuri, este necesar să se utilizeze dezinfectanți micobactericidi, deoarece aceștia sunt eficienți împotriva microorganismelor cu cea mai mare rezistență.
Diagnosticul de laborator al infecției cu HIV
Principala metodă de diagnosticare a purtătorului de virus și a infecției cu HIV este imunotestul enzimatic. Cu toate acestea, datorită faptului că gpl20 are similaritate structurală și antigenică cu receptorii unor celule umane, inclusiv receptorii care transportă imunoglobuline prin celulele epiteliale ale membranelor mucoase, în organism pot apărea anticorpi legați de anticorpii împotriva gpl20. În acest caz, pot exista rezultate ELISA fals pozitive. Prin urmare, toate serurile subiecților care reacționează pozitiv sunt supuse unor analize suplimentare folosind metoda imunoblotting sau Western blotting. Această metodă se bazează pe identificarea anticorpilor studiați după separarea lor electroforetică și testarea ulterioară folosind anticorpi antispecie marcați. Metoda virologică este rar utilizată din cauza complexității cultivării virusului. Clona limfocitelor H9 este utilizată pentru a obține antigene virale - componentele necesare ale sistemelor de testare diagnostică. Metoda CPR permite detectarea virusului într-un stadiu incipient al viremiei.
Tratamentul infecției cu HIV
Este necesar să se găsească sau să se sintetizeze medicamente care să suprime eficient activitatea transcriptazei inverse (revertază) sau a proteazei virale. Acestea ar preveni formarea provirusului ADN și (sau) ar inhiba reproducerea intracelulară a virusului. Strategia modernă de tratare a pacienților infectați cu HIV se bazează pe principiul utilizării combinate a medicamentelor care inhibă proteaza virală (unul dintre medicamente) și reverzaza (2 medicamente diferite) - terapie combinată (triplă). În Rusia, pentru tratamentul pacienților infectați cu HIV, se recomandă utilizarea combinată a 2 medicamente autohtone: fosfazidă și crixivan, care suprimă în mod specific reproducerea HIV în stadiile incipiente și tardive ale reproducerii, în special cu activitate redusă a azidotimidinei.
Problema profilaxiei specifice constă în necesitatea creării unui vaccin care să asigure formarea unei imunități mediate celular eficiente, bazată pe limfocite citotoxice specifice virusului, fără nicio producție semnificativă de anticorpi. O astfel de imunitate este asigurată de helperii Thl. Este posibil ca anticorpii, inclusiv cei neutralizanți ai virusului, să fie nu numai ineficienți în suprimarea infecției cu HIV, dar la un nivel ridicat să suprime imunitatea mediată celular. Prin urmare, un vaccin anti-HIV trebuie să îndeplinească, în primul rând, două cerințe principale: a) să fie absolut sigur și b) să stimuleze activitatea limfocitelor T citotoxice. Se studiază eficacitatea diferitelor variante de vaccin obținute din virusuri ucise (inactivate) și din antigene individuale cu proprietăți protectoare ridicate. Astfel de antigene pot fi fie izolate din virionii înșiși, fie sintetizate chimic. A fost propus un vaccin creat pe baza metodelor de inginerie genetică. Este un virus vaccinia recombinant care poartă gene HIV responsabile de sinteza antigenelor cu proprietăți imunogene puternice. Problema eficacității acestor vaccinuri necesită un timp considerabil din cauza perioadei lungi de incubație a infecției cu HIV și a variabilității ridicate a agentului patogen. Crearea unui vaccin extrem de eficient împotriva HIV este o problemă fundamentală urgentă.

