Expert medical al articolului
Noile publicații
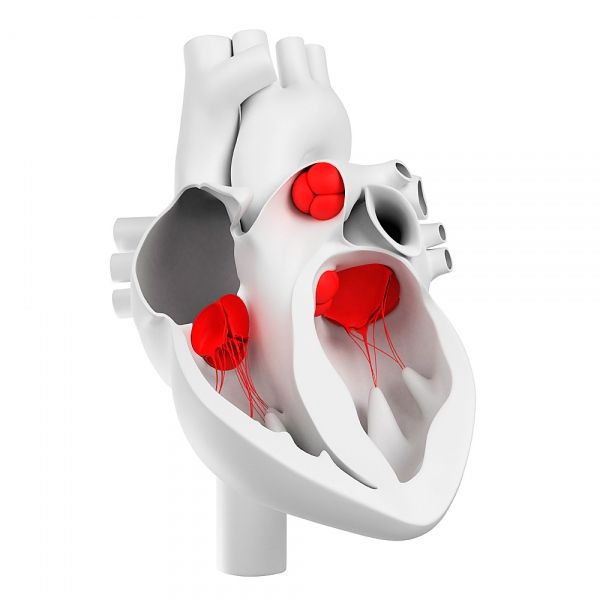
Valve cardiace
Ultima examinare: 04.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Anterior se credea că toate valvele cardiace erau structuri simple a căror contribuție la fluxul sanguin unidirecțional era pur și simplu mișcarea pasivă ca răspuns la un gradient de presiune aplicat. Această înțelegere a „structurilor pasive” a dus la dezvoltarea unor înlocuitori de valve mecanice și biologice „pasive”.
Acum devine evident că valvele cardiace au o structură și o funcție mai complexe. Prin urmare, crearea unui substitut „activ” al valvei cardiace presupune o similaritate semnificativă în structură și funcție cu valva cardiacă naturală, ceea ce în viitor este destul de realist datorită dezvoltării ingineriei tisulare.
Valvele cardiace se dezvoltă din rudimente embrionare de țesut mezenchimal în timpul formării endocardului. În timpul morfogenezei, se formează canalul atrioventricular (valvele cardiace tricuspidă și mitrală) și tractul de ejecție ventricular (valvele cardiace aortice și pulmonare).
Cum sunt aranjate valvele cardiace?
Studiul vascularizației valvelor a fost inițiat de N. Luschka (1852), care a injectat vasele inimii cu o masă de contrast. El a descoperit numeroase vase de sânge în cuspidele valvelor atrioventriculare și semilunare ale aortei și arterei pulmonare. În același timp, o serie de manuale de anatomie patologică și histologie conțineau indicații conform cărora valvele cardiace umane nemodificate nu conțin vase de sânge, iar acestea din urmă apar în valve doar în diverse procese patologice - ateroscleroză și endocardită de diverse etiologii. Informațiile despre absența vaselor de sânge s-au bazat în principal pe studii histologice. S-a presupus că, în absența vaselor de sânge în partea liberă a cuspizilor, nutriția acestora are loc prin filtrarea fluidului din plasma sanguină care spală cuspizii. S-a observat pătrunderea câtorva vase împreună cu fibre de țesut muscular striat în bazele valvelor și corzile tendinoase.
Totuși, la injectarea vaselor cardiace cu diverși coloranți (cerneală indiană în gelatină, bismut în gelatină, suspensie apoasă de cerneală indiană neagră, soluții de carmin sau albastru de tripan), s-a constatat că vasele pătrund în valvele cardiace atrioventriculare, valvele aortice și artera pulmonară împreună cu țesutul muscular cardiac, puțin înainte de a ajunge la marginea liberă a valvei.
În țesutul conjunctiv fibros lax al cuspidelor valvei atrioventriculare, s-au găsit vase principale individuale care se anastomozează cu vase din zonele adiacente ale țesutului muscular striat cardiac.
Cel mai mare număr de vase de sânge se aflau la bază, iar un număr relativ mai mic în partea liberă a acestor valve.
Conform lui K.I. Kulchitsky și colab. (1990), în valva mitrală se găsește un diametru mai mare al vaselor arteriale și venoase. La baza cuspidelor acestei valve sunt situate în principal vasele principale cu o rețea îngustă de capilare, care pătrund în partea bazală a cuspidei și ocupă 10% din suprafața acesteia. În valva tricuspidă, vasele arteriale au un diametru mai mic decât în valva mitrală. În cuspidele acestei valve există în principal vase dispersate și bucle relativ largi de capilare sanguine. În valva mitrală, cuspida anterioară este alimentată cu sânge mai intens, în valva tricuspidă - cuspidele anterioară și posterioară, care îndeplinesc funcția principală de închidere. Raportul dintre diametrele vaselor arteriale și venoase din valvele atrioventriculare ale inimii persoanelor mature este de 1:1,5. Buclele capilare sunt poligonale și sunt situate perpendicular pe baza cuspidelor valvei. Vasele formează o rețea planară situată sub endoteliu pe partea atrială. Vasele de sânge se găsesc și în corzile tendinoase, unde pătrund din mușchii papilari ai ventriculelor drept și stâng la o distanță de până la 30% din lungimea corzilor tendinoase. Numeroase vase de sânge formează bucle arcuite la baza corzilor tendinoase. Valvele cardiace ale aortei și trunchiului pulmonar diferă semnificativ de valvele atrioventriculare în ceea ce privește alimentarea cu sânge. Vasele principale cu un diametru relativ mai mic se apropie de baza cuspizilor semilunari ai valvelor aortei și trunchiului pulmonar. Ramurile scurte ale acestor vase se termină în bucle capilare de formă ovală și poligonală neregulată. Acestea sunt situate în principal în apropierea bazei cuspizilor semilunari. Vasele venoase de la baza valvelor aortice și pulmonare au, de asemenea, un diametru mai mic decât cele de la baza valvelor atrioventriculare. Raportul dintre diametrele vaselor arteriale și venoase din valvele aortice și pulmonare ale inimii persoanelor mature este de 1:1,4. Ramuri laterale scurte se extind din vasele mai mari, terminându-se în bucle de capilare de forme ovale și poligonale neregulate.

Odată cu vârsta, există o îngroșare a fibrelor țesutului conjunctiv, atât colagene, cât și elastice, precum și o scădere a cantității de țesut conjunctiv fibros lax neformat, se dezvoltă scleroza țesutului cuspidelor valvelor atrioventriculare și a cuspidelor semilunare ale valvelor arterelor aortice și pulmonare. Lungimea fibrelor musculare striate cardiace din valve scade și, în consecință, cantitatea acestora și numărul vaselor de sânge care penetrează valvele cardiace scad. Din cauza acestor modificări, valvele cardiace își pierd proprietățile elastice și rezistente, ceea ce afectează mecanismul de închidere a valvelor și hemodinamica.
Valvele cardiace au rețele de capilare limfatice și un număr mic de vase limfatice echipate cu valve. Capilarele limfatice ale cuspidelor au un aspect caracteristic: lumenul lor este foarte neuniform, același capilar în zone diferite are un diametru diferit. În locurile unde se unesc mai multe capilare, se formează expansiuni - lacune de diferite forme. Buclele rețelelor sunt adesea poligonale neregulate, mai rar ovale sau rotunde. Adesea, buclele rețelelor limfatice nu sunt închise, iar capilarele limfatice se termină orb. Buclele capilarelor limfatice sunt orientate cel mai adesea în direcția de la marginea liberă a cuspidei către baza acesteia. În unele cazuri, în cuspidele valvei atrioventriculare s-a găsit o rețea dublă de capilare limfatice.
Plexurile nervoase endocardice sunt situate în diferitele sale straturi, în principal sub endoteliu. La marginea liberă a cuspizilor valvelor, fibrele nervoase sunt situate în principal radial, conectându-se cu cele ale corzilor tendinoase. Mai aproape de baza cuspizilor, se formează un plex nervos cu ochiuri largi, care se conectează cu plexul situat în jurul inelelor fibroase. Pe cuspizii semilunari, rețeaua nervoasă endocardică este mai rară. La locul de atașare a valvelor, aceasta devine densă și multistratificată.
Structura celulară a valvelor cardiace
Celulele interstițiale valvulare, responsabile de menținerea structurii valvei, au o formă alungită, cu numeroase procese fine care se extind în întreaga matrice valvulară. Există două populații de celule interstițiale valvulare care diferă prin morfologie și structură; una are proprietăți contractile și este caracterizată prin prezența fibrilelor contractile, cealaltă are proprietăți secretorii și are un reticul endoplasmatic și un aparat Golgi bine dezvoltate. Funcția contractilă rezistă presiunii hemodinamice și este susținută în continuare de producerea de proteine contractile cardiace și scheletice, care includ lanțurile grele de alfa- și beta-miozină și diverse izoforme de troponină. Contracția valvei cardiace a fost demonstrată ca răspuns la o serie de agenți vasoactivi, sugerând un stimul biologic coordonat pentru funcționarea cu succes a valvei.
Celulele interstițiale sunt, de asemenea, componente esențiale ale sistemului de reparare a structurilor precum valvele cardiace. Mișcarea constantă a valvelor și deformarea asociată a țesutului conjunctiv produc leziuni la care celulele interstițiale valvulare răspund pentru a menține integritatea valvei. Procesul de reparare pare a fi vital pentru funcția normală a valvei, iar absența acestor celule în modelele actuale de valve artificiale este probabil un factor care contribuie la deteriorarea structurală a bioprotezelor.
O arie importantă de cercetare în domeniul celulelor interstițiale este studiul interacțiunilor dintre acestea și matricea înconjurătoare, mediate de moleculele de adeziune focală. Aderențele focale sunt situsuri specializate de interacțiune celulă-matrice care leagă citoscheletul celular de proteinele matricei prin intermediul integrinelor. De asemenea, ele acționează ca situsuri de transducție a semnalului, transmițând informații mecanice din matricea extracelulară care pot declanșa răspunsuri, inclusiv, dar fără a se limita la, aderența celulară, migrarea, creșterea și diferențierea. Înțelegerea biologiei celulare a celulelor interstițiale valvulare este vitală pentru elucidarea mecanismelor prin care aceste celule interacționează între ele și cu mediul lor, astfel încât această funcție să poată fi recapitulată în valvele artificiale.
În legătură cu dezvoltarea unei direcții promițătoare de inginerie tisulară a valvelor cardiace, studiile celulelor interstițiale sunt efectuate folosind o gamă largă de tehnici. Prezența citoscheletului celular este confirmată prin colorare pentru vimentină, desmină, troponină, alfa-actină și miozină musculară netedă, lanțuri grele de alfa- și beta-miozină, lanțuri ușoare-2 de miozină cardiacă, alfa- și beta-tubulină. Contractilitatea celulară este confirmată de un răspuns pozitiv la epinefrină, angiotensină II, bradicinină, carbacol, clorură de potasiu, endoteliu I. Interrelațiile celulare sunt determinate prin interacțiuni funcționale și verificate prin microinjecții de carboxifluoresceină. Secreția matriceală este stabilită prin colorare pentru prolil-4-hidroxilază / colagen de tip II, fibronectină, sulfat de condroitină, laminină. Inervația se stabilește prin amplasarea apropiată a terminațiilor nervoase motorii, ceea ce se reflectă prin activitatea neuropeptidei Y tirozin hidroxilazei, acetilcolinesterazei, polipeptidei intestinale vasoactive, substanței P, peptidei legate de gena capsicum. Factorii mitogenici sunt estimați prin factorul de creștere derivat din trombocite, factorul de creștere bazic al fibroblastelor, serotonina (5-HT). Fibroblastele celulelor interstițiale studiate sunt caracterizate printr-o membrană bazală incompletă, procese citoplasmatice lungi și subțiri, legătură strânsă cu matricea, reticul endoplasmatic inegal bine dezvoltat și aparat Golgi, bogăție în microfilamente, formarea de legături adezive.
Celulele endocardice valvulare formează o teacă atrombogenă funcțională în jurul fiecărei valve cardiace, similară endoteliului vascular. Metoda utilizată pe scară largă de înlocuire a valvelor elimină funcția protectoare a endocardului, ceea ce poate duce la depunerea de trombocite și fibrină pe valvele artificiale, dezvoltarea infecțiilor bacteriene și calcificarea țesuturilor. O altă funcție probabilă a acestor celule este reglarea celulelor interstițiale valvulare subiacente, similară reglării celulelor musculare netede de către endoteliu. Există interacțiuni complexe între endoteliu și celulele adiacente, mediate parțial de factori solubili secretați de celulele endoteliale. Aceste celule formează o suprafață imensă acoperită cu microprotuberanțe pe partea luminală, crescând astfel expunerea și posibila interacțiune cu substanțele metabolice din sângele circulant.
Endoteliul prezintă adesea diferențe morfologice și funcționale cauzate de tensiunile de forfecare asupra peretelui vasului din cauza fluxului sanguin, iar acest lucru este valabil și pentru celulele endocardice valvulare, care adoptă o formă alungită sau poligonală. Modificări ale structurii celulare pot apărea datorită acțiunii hemodinamicii locale asupra componentelor citoscheletului celular sau efectelor secundare cauzate de modificările matricei extracelulare subiacente. La nivel ultrastructural, celulele endocardice valvulare posedă conexiuni intercelulare, vezicule plasmatice, un reticul endoplasmatic rugos și un aparat Golgi. Deși produc factor von Willebrand atât in vivo, cât și in vitro, le lipsesc corpii Weibel-Palade (granule specifice care conțin factorul von Willebrand), care sunt organite caracteristice endoteliului vascular. Celulele endocardice valvulare sunt caracterizate prin joncțiuni puternice, interacțiuni funcționale și pliuri marginale suprapuse.
Celulele endocardice își păstrează activitatea metabolică chiar și in vitro: produc factor von Willebrand, prostaciclină, sintază de oxid nitric, demonstrează activitate enzimatică de conversie a angiotensinei și secretă intensiv molecule de adeziune ICAM-1 și ELAM-1, care sunt importante pentru legarea celulelor mononucleare în timpul dezvoltării unui răspuns imun. Toți acești markeri ar trebui luați în considerare la cultivarea unei culturi celulare ideale pentru crearea unei valve artificiale folosind ingineria tisulară, însă potențialul imunostimulator al celulelor endocardice valvulare în sine poate limita utilizarea lor.
Matricea extracelulară a valvelor cardiace este formată din macromolecule fibroase de colagen și elastină, proteoglicani și glicoproteine. Colagenul reprezintă 60% din greutatea uscată a valvei, elastina 10% și proteoglicanii 20%. Componenta de colagen asigură principala stabilitate mecanică a valvei și este reprezentată de colageni de tip I (74%), II (24%) și V (2%). Fasciculele de fire de colagen sunt înconjurate de o teacă de elastină, care mediază interacțiunile dintre ele. Lanțurile laterale de glicozaminoglicani ale moleculelor de proteoglican tind să formeze o substanță gelatinoasă în care alte molecule matriceale interacționează pentru a forma legături permanente și se depun alte componente. Glicozaminoglicanii valvelor cardiace umane constau în principal din acid hialuronic, într-o măsură mai mică din dermatan sulfat, condroitină-4-sulfat și condroitină-6-sulfat, cu o cantitate minimă de heparan sulfat. Remodelarea și reînnoirea țesutului matriceal sunt reglate de metaloproteinazele matriceale (MMP) și inhibitorii lor tisulari (TI). Aceste molecule sunt, de asemenea, implicate într-o gamă mai largă de procese fiziologice și patologice. Unele metaloproteinaze, inclusiv colagenazele interstițiale (MMP-1, MMP-13) și gelatinazele (MMP-2, MMP-9) și inhibitorii lor tisulari (TI-1, TI-2, TI-3), se găsesc în toate valvele cardiace. Producția excesivă de metaloproteinaze este caracteristică stărilor patologice ale valvei cardiace.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Valvele cardiace și structura lor morfologică
Valvele cardiace sunt alcătuite din trei straturi ale matricei valvelor, diferite din punct de vedere morfologic și semnificative din punct de vedere funcțional: fibros, spongios și ventricular.
Stratul fibros formează o structură rezistentă la sarcină pentru valva valvulară, constând din straturi de fibre de colagen. Aceste fibre sunt dispuse radial în pliuri pentru a permite valvelor arteriale să se întindă la închidere. Stratul fibros se află în apropierea suprafeței exterioare de ieșire a acestor valve. Stratul fibros al valvelor atrioventriculare servește ca o continuare a fasciculelor de colagen ale corzilor tendinoase. Acesta este situat între stratul spongios (de intrare) și stratul ventricular (de ieșire).
Între straturile fibroase și ventriculare se află stratul spongios (spongiosa). Stratul spongios este alcătuit din țesut conjunctiv slab organizat într-un mediu vâscos. Componentele matriceale dominante ale acestui strat sunt proteoglicanii cu colagen orientat aleatoriu și straturi subțiri de elastină. Lanțurile laterale ale moleculelor de proteoglicani poartă o sarcină negativă puternică, ceea ce afectează capacitatea lor ridicată de a lega apa și de a forma un gel matriceal poros. Stratul spongios al matricei reduce stresul mecanic din valvele cardiace și le menține flexibilitatea.
Stratul ventricular este mult mai subțire decât celelalte și este bogat în fibre elastice care permit țesutului să reziste deformării constante. Elastina are o structură spongioasă care înconjoară și conectează fibrele de colagen și le menține într-o stare pliată neutră. Stratul de intrare al valvei (ventricular - pentru valvele arteriale și spongios - pentru atrioventricular) conține mai multă elastină decât cel de ieșire, ceea ce asigură atenuarea șocului hidraulic atunci când cuspidele se închid. Această relație dintre colagen și elastină permite cuspidelor să se întindă până la 40% fără deformare stabilă. Când sunt expuse la o sarcină mică, structurile de colagen ale acestui strat sunt orientate în direcția sarcinii, iar rezistența sa la creșterea ulterioară a sarcinii crește.
Astfel, ideea valvelor cardiace ca simple duplicații endocardice este nu numai simplificată, ci și în esență incorectă. Valvele cardiace sunt organe complexe care includ fibre musculare striate, vase sanguine și limfatice și elemente nervoase. Atât prin structura, cât și prin funcționarea lor, valvele sunt parte integrantă a tuturor structurilor cardiace. Analiza funcției normale a valvelor trebuie să ia în considerare organizarea lor celulară, precum și interacțiunea celulelor între ele și cu matricea. Cunoștințele dobândite din astfel de studii sunt de vârf în proiectarea și dezvoltarea protezelor valvulare folosind ingineria tisulară.

