Expert medical al articolului
Noile publicații
Tratamentul sepsisului sever și al șocului septic
Ultima examinare: 04.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Tratamentul eficient al sepsisului este posibil numai cu igienizarea chirurgicală completă a locului infecției și o terapie antimicrobiană adecvată. Terapia antimicrobiană inițială inadecvată este un factor de risc pentru deces la pacienții cu sepsis. Menținerea vieții pacientului, prevenirea și eliminarea disfuncțiilor organelor sunt posibile numai cu terapie intensivă țintită.
Scopul său principal este de a optimiza transportul de O2 în condiții de consum crescut al acestuia, tipic pentru sepsisul sever și șocul septic. Acest tratament se implementează prin suport hemodinamic și respirator.
Suport hemodinamic
Terapia prin perfuzie
Terapia perfuzabilă este una dintre măsurile inițiale pentru menținerea hemodinamicii și, mai ales, a debitului cardiac. Principalele sale sarcini la pacienții cu sepsis sunt:
- restabilirea unei perfuzii tisulare adecvate,
- corectarea tulburărilor de homeostazie,
- normalizarea metabolismului celular,
- reducerea concentrației mediatorilor cascadei septice și a metaboliților toxici.
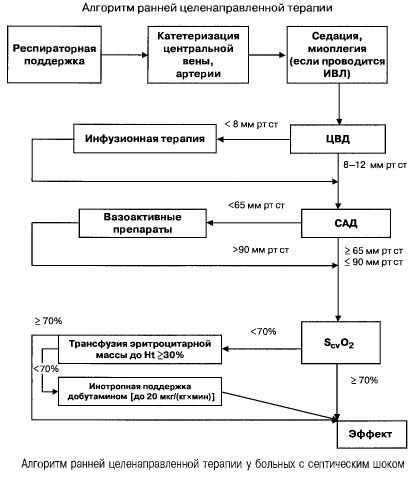
În sepsis cu insuficiență multiplă de organe și șoc septic, se încearcă atingerea rapidă (în primele 6 ore) a următoarelor valori ale indicatorilor importanți:
- hematocrit >30%,
- diureză 0,5 ml/(kg oră),
- saturație sanguină în vena cavă superioară sau atriul drept >70%,
- tensiune arterială medie >65 mm Hg,
- CVP 8-12 mm Hg
Menținerea acestor valori la nivelul specificat îmbunătățește supraviețuirea pacientului (categoria de dovezi B). Monitorizarea hemodinamică utilizând un cateter Swan-Ganz și tehnologia PICCO (termodiluție transpulmonară și analiza undei de puls) extinde posibilitățile de monitorizare și evaluare a eficacității terapiei hemodinamice, dar nu există dovezi că acestea îmbunătățesc supraviețuirea.
Valoarea optimă a preîncărcării este selectată individual, deoarece este necesar să se țină cont de gradul de afectare endotelială și de starea drenajului limfatic din plămâni, de funcția diastolică a ventriculelor și de modificările presiunii intratoracice. Volumul terapiei perfuzabile este selectat astfel încât PCWP să nu depășească COP plasmatic (prevenirea OL) și să existe o creștere a CO. În plus, se iau în considerare parametrii care caracterizează funcția de schimb gazos al plămânilor (paO2 și paO2 / FiO2 ) și modificările imaginii radiografice.
Pentru terapia perfuzabilă, ca parte a tratamentului țintit al sepsisului și șocului septic, se utilizează soluții cristaloide și coloidale, cu rezultate practic identice.
Toate mediile de perfuzie au atât avantaje, cât și dezavantaje. Astăzi, având în vedere rezultatele studiilor experimentale și clinice, nu există niciun motiv pentru a prefera un anumit tip.
- De exemplu, pentru corectarea adecvată a returului venos și a nivelului de precarcare, este necesară administrarea unui volum de cristaloizi de 2-4 ori mai mare decât cel al coloizilor, ceea ce este asociat cu particularitățile distribuției soluției în organism. În plus, perfuzia de cristaloizi este asociată cu un risc mai mare de edem tisular, iar efectul lor hemodinamic este mai scurt decât cel al coloizilor. În același timp, cristaloizii sunt mai ieftini, nu afectează potențialul de coagulare și nu provoacă reacții anafilactoide. Pe baza celor de mai sus, compoziția calitativă a programului de perfuzie se determină în funcție de caracteristicile pacientului, ținând cont de gradul de hipovolemie, faza sindromului CID, prezența edemului periferic și concentrația de albumină în serul sanguin, severitatea leziunii pulmonare acute.
- Substituenții de plasmă (dextrani, preparate gelatinoase, hidroxietilamidon) sunt indicați în cazurile de deficit sever de carcinom basocelular (BCC). Hidroxietilamidonurile cu un grad de substituție de 200/0,5, 130/0,4 și 130/0,42 prezintă un potențial avantaj față de dextrani datorită unui risc mai mic de evadare din membrană și absenței unui efect clinic semnificativ asupra hemostazei.
- Introducerea albuminei în condiții critice poate crește riscul de deces. Creșterea COP în timpul perfuziei sale este tranzitorie, iar apoi, în condiții de permeabilitate crescută a patului capilar (sindromul de „scurgere capilară”), apare o extravazare suplimentară a albuminei. Este posibil ca transfuzia de albumină să fie utilă numai dacă concentrația acesteia în ser este mai mică de 20 g/l și nu există semne de „scurgere” în interstițiu.
- Utilizarea crioplasmei este indicată pentru coagulopatia de consum și scăderea potențialului de coagulare a sângelui.
- Utilizarea pe scară largă a masei de globule roșii de la donatori ar trebui limitată din cauza riscului ridicat de a dezvolta diverse complicații (APL, reacții anafilactice etc.). Conform majorității experților, concentrația minimă de hemoglobină la pacienții cu sepsis sever este de 90-100 g/l.
Corectarea hipotensiunii arteriale
Presiunea scăzută de perfuzie necesită activarea imediată a medicamentelor care cresc tonusul vascular și/sau funcția inotropă a inimii. Dopamina sau norepinefrina sunt medicamentele de primă linie pentru corectarea hipotensiunii arteriale la pacienții cu șoc septic.
Dopamina (dopmin), la o doză <10 mcg/(kg x min), crește tensiunea arterială, în principal prin creșterea GC, și are un efect minim asupra rezistenței vasculare sistemice. La doze mari, efectul său α-adrenergic predomină, ducând la vasoconstricție arterială, iar la o doză <5 mcg/(kg x min) dopamina stimulează receptorii dopaminergici ai vaselor renale, mezenterice și coronariene, ducând la vasodilatație, creșterea filtrării glomerulare și excreția de Na+.
Norepinefrina crește tensiunea arterială medie și crește filtrarea glomerulară. Optimizarea hemodinamicii sistemice sub acțiunea sa duce la îmbunătățirea funcției renale fără utilizarea de doze mici de dopamină. Studiile din ultimii ani au arătat că utilizarea sa izolată, comparativ cu o combinație cu doze mari de dopamină, duce la o scădere semnificativă statistic a mortalității.
Adrenalina este un medicament adrenergic cu cele mai pronunțate efecte secundare hemodinamice. Are un efect dependent de doză asupra ritmului cardiac, presiunii arteriale medii, debitului cardiac, funcției ventriculare stângi și aportului și consumului de O2 . Cu toate acestea, tahiaritmiile, deteriorarea fluxului sanguin al organelor și hiperlactatemia apar simultan. Prin urmare, utilizarea adrenalinei este limitată la cazurile de refractaritate completă la alte catecolamine.
Dobutamina este medicamentul de elecție pentru creșterea aportului și consumului de CO și O2 la preîncărcare normală sau crescută. Datorită acțiunii sale predominante asupra receptorilor beta1-adrenergici, este mai eficientă decât dopamina în creșterea acestor parametri.
Studiile experimentale au arătat că catecolaminele, pe lângă faptul că susțin circulația sângelui, pot regla cursul inflamației sistemice prin influențarea sintezei mediatorilor cheie cu efect la distanță. Sub influența adrenalinei, dopaminei, noradrenalinei și dobutaminei, macrofagele activate reduc sinteza și secreția de TNF-α.
Selecția agenților adrenergici se efectuează conform următorului algoritm:
- indice cardiac 3,5-4 l/(min x m² ), SvO² > 70% - dopamină sau norepinefrină,
- indice cardiac <3,5 l/(min x m2 ), SvO2 < 70% - dobutamină (dacă tensiunea arterială sistolică <70 mm Hg - împreună cu norepinefrină sau dopamină).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Suport respirator
Plămânii sunt printre primele organe țintă implicate în procesul patologic din sepsis. Insuficiența respiratorie acută este una dintre componentele principale ale disfuncției multiple de organe. Manifestările sale clinice și de laborator în sepsis corespund insuficienței respiratorii parenchimatoase (ALI), iar odată cu progresia procesului patologic - SDRA. Indicațiile pentru ventilația mecanică în sepsisul sever sunt determinate în funcție de severitatea insuficienței respiratorii parenchimatoase (IRA sau SDRA). Criteriul său este indicele respirator:
- <200 - sunt indicate intubația traheală și suportul respirator,
- >200 - citirile sunt determinate individual.
Dacă pacientul este conștient în timpul respirației spontane cu suport de oxigen, nu există un efort respirator ridicat și tahicardie pronunțată (FC <120 pe minut), valoarea normală a returului venos SO2 > 90%, atunci este posibil să se evite transferul acestuia la ventilație artificială. Cu toate acestea, este necesară monitorizarea atentă a stării pacientului. Valoarea optimă a SO2 este de aproximativ 90%. Aceasta poate fi menținută prin diverse metode de administrare a gazelor (măști faciale, catetere nazale) în concentrații netoxice (FiO2 < 0,6). Ventilația artificială neinvazivă este contraindicată în sepsis (categoria de evidență B).
Modurile de ventilație mecanică cu volum mare (VMV) (VO = 12 ml/kg) trebuie evitate, deoarece în astfel de cazuri secreția de citokine de către plămâni crește, ceea ce duce la agravarea MOF. Este necesar să se respecte conceptul de ventilație mecanică sigură, ceea ce este posibil dacă sunt îndeplinite următoarele condiții (categoria de evidență A):
- DO <10 ml/kg,
- raportul neinversat dintre inhalare și expirare,
- presiunea maximă a căilor respiratorii <35 cm H2O,
- FiO2 <0,6 .
Selecția parametrilor ciclului respirator se efectuează până la obținerea unei ventilații mecanice adecvate, criteriile acesteia fiind paO2 > 60 mm Hg, SpO2 > 88-93%, pvO2 35-45 mm Hg, SvO2 > 55%.
Una dintre metodele eficiente pentru optimizarea schimbului de gaze este efectuarea ventilației artificiale în poziția de decubit ventral (Prone Positioning) (categoria de evidență B). Această poziție este eficientă la pacienții aflați în starea cea mai severă, deși efectul său asupra reducerii mortalității pe termen lung este nesemnificativ statistic.
Suport nutrițional
Efectuarea suportului nutrițional artificial este un element important al tratamentului, una dintre măsurile obligatorii, deoarece dezvoltarea sindromului de insuficiență multiplă de organe în sepsis este de obicei însoțită de manifestări de hipermetabolism. Într-o astfel de situație, nevoile energetice sunt satisfăcute prin distrugerea propriilor structuri celulare (autocanibalism), ceea ce agravează disfuncția organelor și crește endotoxicoza.
Suportul nutrițional este considerat o metodă de prevenire a epuizării severe (deficienței proteino-energetice) pe fondul unei creșteri pronunțate a cata- și metabolismului. Includerea nutriției enterale în complexul de terapie intensivă previne mișcarea microflorei intestinale, disbacterioza, crește activitatea funcțională a enterocitelor și proprietățile protectoare ale mucoasei intestinale. Acești factori reduc gradul de endotoxicoză și riscul complicațiilor infecțioase secundare.
Calculul suportului nutrițional:
- valoare energetică - 25-35 kcal/(kg greutate corporală x zi),
- cantitatea de proteine - 1,3-2,0 g/(kg greutate corporală x zi),
- cantitatea de carbohidrați (glucoză) - mai puțin de 6 g/kg/zi,
- cantitatea de grăsime - 0,5-1 g/kg/zi,
- dipeptide de glutamină 0,3-0,4 g/kg/zi,
- vitamine - doză zilnică standard + vitamina K (10 mg/zi) + vitaminele B1 și B6 ( 100 mg/zi) + vitaminele A, C, E,
- microelemente - doză zilnică standard + Zn (15-20 mg/zi + 10 mg/zi în prezența scaunelor moi),
- electroliți - Na+, K+, Ca2+ conform calculelor de bilanț și concentrației plasmatice.
Inițierea timpurie a suportului nutrițional (24-36 de ore) este mai eficientă decât în a 3-a-4-a zi de terapie intensivă (categoria de dovezi B), în special în cazul alimentației enterale prin sondă.
În sepsisul sever, nutriția enterală sau parenterală nu prezintă avantaje; durata disfuncției organice și durata suportului respirator și inotrop sunt aceleași, iar ratele mortalității sunt aceleași. Având în vedere cele de mai sus, nutriția enterală precoce este o alternativă mai ieftină la nutriția parenterală. Utilizarea amestecurilor îmbogățite cu fibre alimentare (prebiotice) pentru alimentația prin sondă reduce semnificativ incidența diareei la pacienții cu sepsis sever.
Pentru o sinteză eficientă a proteinelor în organism, este important să se mențină raportul metabolic „azot total, g - calorii neproteice, kcal” = 1-(110-130). Doza maximă de carbohidrați este de 6 g / (kg greutate corporală pe zi), deoarece introducerea în doze mari amenință hiperglicemia și activarea catabolismului în mușchii scheletici. Se recomandă administrarea emulsiilor de grăsime non-stop.
Contraindicații pentru suportul nutrițional:
- acidoză metabolică decompensată,
- intoleranță individuală la mediile de susținere nutrițională,
- hipovolemie severă nerecuperată,
- șoc refractar - doză de dopamină >15 mcg/(kg x min) și tensiune arterială sistolică <90 mm Hg,
- hipoxemie arterială severă și refractară.
Controlul glicemic
Un aspect important al tratamentului complex al sepsisului sever este monitorizarea constantă a concentrației de glucoză din plasma sanguină și insulinoterapia. Glicemia ridicată și necesitatea corectării acesteia sunt factori de prognostic nefavorabil în sepsis. Având în vedere circumstanțele menționate mai sus, normoglicemia (4,5-6,1 mmol/l) este menținută la pacienți, pentru care, atunci când concentrația de glucoză crește peste valorile acceptabile, se efectuează perfuzie de insulină (0,5-1 U/h). În funcție de situația clinică, concentrația de glucoză este monitorizată la fiecare 1-4 ore. Prin implementarea acestui algoritm, s-a observat o creștere semnificativă statistic a supraviețuirii pacienților.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glucocorticoizi
Rezultatele studiilor moderne privind eficacitatea utilizării glucocorticoizilor la pacienții cu șoc septic sunt rezumate în următoarele afirmații:
- este inadecvată utilizarea hormonilor în doze mari [metilprednisolon 30-120 mg/(kg x zi) o dată sau timp de 9 zile, dexametazonă 2 mg/(kg x zi) timp de 2 zile, betametazonă 1 mg/(kg x zi) timp de 3 zile] - risc crescut de infecții spitalicești, fără efect asupra supraviețuirii,
- Utilizarea hidrocortizonului în doză de 240-300 mg pe zi, timp de 5-7 zile, accelerează stabilizarea parametrilor hemodinamici, permite retragerea suportului vascular și îmbunătățește supraviețuirea la pacienții cu insuficiență adrenală relativă concomitentă (categoria de evidență B).
Este necesară abandonarea prescrierii empirice haotice de prednisolon și dexametazonă - nu există motive pentru extrapolarea de informații noi la acestea. În absența dovezilor de laborator privind insuficiența suprarenală relativă, se administrează hidrocortizon în doză de 300 mg pe zi (în 3-6 injecții).
- în șocul refractar,
- dacă sunt necesare doze mari de vasopresoare pentru menținerea unei hemodinamici eficiente.
Este posibil ca în condiții de inflamație sistemică în șocul septic, eficacitatea hidrocortizonului să fie asociată cu activarea inhibitorului factorului nuclear kB (NF-kB-a) și corectarea insuficienței adrenale relative. La rândul său, inhibarea activității factorului nuclear de transcripție (NF-kB) duce la o scădere a formării NO sintetazei inductibile (NO este cel mai puternic vasodilatator endogen), a citokinelor proinflamatorii, a COX și a moleculelor de adeziune.
Proteina C activată
Una dintre manifestările caracteristice ale sepsisului este perturbarea coagulării sistemice (activarea cascadei de coagulare și inhibarea fibrinolizei), ceea ce duce în cele din urmă la hipoperfuzie și disfuncție organică. Efectul proteinei C activate asupra sistemului inflamator se realizează în mai multe moduri:
- reducerea atașării selectinei la leucocite, ceea ce protejează endoteliul de deteriorare, ceea ce joacă un rol cheie în dezvoltarea inflamației sistemice,
- eliberarea scăzută de citokine din monocite,
- blocarea eliberării TNF-α din leucocite,
- inhibarea producției de trombină (potențează răspunsul inflamator).
Acțiune anticoagulantă, profibrinolitică și antiinflamatoare
- Proteina C activată se datorează
- degradarea factorilor Va și VIIIa - suprimarea formării trombilor,
- supresia inhibitorului activatorului plasminogenului - activarea fibrinolizei,
- efect antiinflamator direct asupra celulelor endoteliale și neutrofilelor,
- protecția endoteliului împotriva apoptozei
Administrarea proteinei C activate [drotrecogin alfa (activată)] la 24 mcg/(kg h) timp de 96 h reduce riscul de deces cu 19,4%. Indicații pentru administrare: sepsis cu MOF acut și risc crescut de deces (APACHE II > 25 puncte, disfuncție a 2 sau mai multe organe, categoria de evidență B).
Proteina C activată nu reduce mortalitatea la copii, pacienți cu disfuncție monoorganică, scor APACHE II < 25 de puncte, la pacienți cu sepsis nechirurgical.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Imunoglobuline
Recomandarea administrării intravenoase a imunoglobulinelor (IgG și IgG+IgM) este asociată cu capacitatea acestora de a limita acțiunea excesivă a citokinelor proinflamatorii, de a crește clearance-ul endotoxinelor și al superantigenului stafilococic, de a elimina anergia și de a spori efectul antibioticelor β-lactamice. Utilizarea lor în tratamentul sepsisului sever și al șocului septic este singura metodă de imunocorecție care crește supraviețuirea. Cel mai bun efect a fost înregistrat la utilizarea unei combinații de IgG și IgM [RR=0,48 (0,35-0,75), categoria de evidență A]. Schema standard de dozare este de 3-5 ml/(kg x zi) timp de 3 zile consecutiv. La utilizarea imunoglobulinelor, cele mai optime rezultate au fost obținute în faza incipientă a șocului („șoc cald”) și la pacienții cu sepsis sever (scor APACHE II de 20-25 puncte).
Prevenirea trombozei venoase profunde
Prevenirea trombozei venoase profunde (TVP) a extremităților inferioare afectează semnificativ rezultatele tratamentului la pacienții cu sepsis (categoria de evidență A). În acest scop se utilizează atât heparine nefracționate, cât și heparine cu greutate moleculară mică (LMWH). Principalele avantaje ale heparinelor cu greutate moleculară mică sunt o incidență mai mică a complicațiilor hemoragice, un efect mai slab asupra funcției plachetare și un efect de lungă durată (poate fi administrat o dată pe zi).
Prevenirea formării ulcerelor de stres ale tractului gastrointestinal
Această direcție joacă un rol semnificativ în obținerea unui rezultat favorabil în tratamentul pacienților cu sepsis sever și șoc septic, deoarece rata mortalității pentru sângerarea din cauza ulcerelor de stres ale tractului gastrointestinal este de 64-87%. Fără măsuri preventive, ulcerele de stres apar la 52,8% dintre pacienții în stare critică. Cu toate acestea, utilizarea inhibitorilor pompei de protoni și a blocanților receptorilor histaminei H2 reduce riscul de peste 2 ori (primul grup de medicamente este mai eficient decât al doilea). Principala direcție de prevenire și tratament este menținerea pH-ului în intervalul 3,5-6,0. Trebuie subliniat faptul că, pe lângă medicamentele menționate mai sus, nutriția enterală joacă un rol important în prevenirea formării ulcerelor de stres.
Purificarea extracorporală a sângelui
Diverse substanțe biologic active și produse metabolice implicate în dezvoltarea inflamației generalizate sunt ținte pentru metodele de detoxifiere, ceea ce este deosebit de important în absența clearance-ului hepatorenal natural în condiții de insuficiență multiplă de organe. Metodele de terapie de substituție renală sunt considerate promițătoare, deoarece pot afecta nu numai tulburările uremice la pacienții cu insuficiență renală, ci au și un efect pozitiv asupra altor modificări ale homeostaziei și disfuncțiilor organice care apar în sepsis, șoc și insuficiență multiplă de organe.
Până în prezent, nu există date care să confirme necesitatea utilizării metodelor extracorporale de purificare a sângelui ca una dintre principalele direcții de terapie patogenetică a sepsisului și șocului septic. Utilizarea lor este justificată în cazul insuficienței multiple de organe cu dominanță renală.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodializă
Esența metodei constă în difuzia substanțelor cu greutate moleculară mică (până la 5x10³ Da ) printr-o membrană semipermeabilă și îndepărtarea excesului de lichid din organism de-a lungul unui gradient de presiune. Hemodializa este utilizată pe scară largă pentru tratarea pacienților cu insuficiență renală cronică și acută. Rata de difuzie a substanțelor depinde exponențial de greutatea lor moleculară. De exemplu, eliminarea oligopeptidelor este mai lentă decât sinteza lor.
Hemofiltrare
Hemofiltrarea este o metodă eficientă pentru îndepărtarea substanțelor cu o greutate moleculară de 5x10³ - 5x10⁴Da și singura modalitate de a elimina din organism un grup mare de substanțe biologic active și metaboliți. Metoda se bazează pe metoda convecției de transfer de masă. Pe lângă corectarea adecvată a azotemiei, hemofiltrarea elimină eficient anafilatoxinele C3a, C5a, citokinele proinflamatorii (TNF-a, IL-1b, 6 și 8), β2-microglobulina, mioglobina, hormonul paratiroidian, lizozimul (greutate moleculară - 6000 Da), α-amilaza (greutate moleculară - 36.000-51.000 Da), creatin fosfokinaza, fosfataza alcalină, transaminazele și alte substanțe. Hemofiltrarea elimină aminoacizii și proteinele plasmatice (inclusiv imunoglobulinele și complexele imune circulante).
Hemodiafiltrare
Hemodiafiltrarea este cea mai puternică metodă de purificare a sângelui, combinând difuzia și convecția (adică GD și GF). O contribuție suplimentară la procesul de detoxifiere o are sorbția substanțelor patologice pe membrana filtrantă.
Plasmafereză
Plasmafereza (schimbul de plasmă, filtrarea plasmei) este, de asemenea, considerată o posibilă metodă pentru corectarea inflamației generalizate la pacienții cu sepsis și șoc septic. Metoda optimă este considerată a fi utilizarea schimbului de plasmă în mod continuu, cu îndepărtarea a 3-5 volume de plasmă și înlocuirea simultană a acesteia cu soluții proaspăt congelate, de albumină, coloidale și cristaloide. Cu un coeficient de cernere de 1, filtrarea plasmei asigură o bună îndepărtare a proteinei C reactive, haptoglobinei, fragmentului de complement C3, 1-antitripsinei, IL-6, tromboxanului-B2, factorului de stimulare a granulocitelor, TNF. Utilizarea sorbenților pentru purificarea plasmei pacientului reduce riscul de infecție și reduce costul procedurii, deoarece nu este nevoie să se utilizeze proteine străine.
Utilizarea perfuziei prelungite de selenit de sodiu (selenază) 1000 mcg/zi în sepsisul sever duce la o scădere a mortalității.
Seleniul este un microelement esențial, a cărui importanță este asociată cu rolul său cheie în sistemele antioxidante ale celulelor. Nivelul de seleniu din sânge este menținut între 1,9-3,17 μM/l. Necesarul de seleniu este de 50-200 μg pe zi și depinde de disponibilitatea altor antioxidanți și microelemente.
Seleniul este un antioxidant puternic, o componentă a glutation peroxidazei, fosfolin glutation peroxidazei, altor oxidoreductaze și unor transferaze. Glutation peroxidaza este cea mai importantă verigă din sistemul antioxidant endogen.
Eficacitatea seleniului în condiții critice a fost studiată în ultimii ani. Aceste studii au arătat că principalele mecanisme de acțiune ale seleniului sunt:
- suprimarea hiperactivării NF-kB;
- activare scăzută a complementului;
- acțiunea sa ca imunomodulator, antioxidant și antiinflamator
- menținerea utilizării peroxidului;
- suprimarea aderenței endoteliale (expresie redusă a ICAM-1, VCAM-2,
- E - selectină, P - selectină);
- protejarea endoteliului de oxiradicali (folosind selenoproteina P, care previne formarea peroxinitritului din O2 și NO).
Pentru a rezuma cele de mai sus, putem defini sarcini specifice ale terapiei intensive pentru sepsisul sever:
- Suport hemodinamic: PVC 8-12 mm Hg, TA medie >65 mm Hg, diureză 0,5 ml/(kg h), hematocrit >30%, saturație sanguină venoasă mixtă >70%.
- Presiune maximă în căile respiratorii în suport respirator <35 cm H2O, fracție inspiratorie de oxigen <60%, volum curent <10 ml/kg, raport inspirator/expirator neinversat.
- Glucocorticoizi - „doze mici” (hidrocortizon 240-300 mg pe zi).
- Proteină C activată 24 mcg/(kg h) timp de 4 zile în sepsis sever (APACHE II >25).
- Terapia de substituție imunocorectoare cu pentaglobină.
- Prevenirea trombozei venoase profunde a extremităților inferioare.
- Prevenirea formării ulcerelor de stres ale tractului gastrointestinal: utilizarea inhibitorilor pompei de protoni și a blocanților receptorilor histaminei H2.
- Terapia de substituție pentru insuficiența renală acută.
- Suport nutrițional: valoarea energetică a alimentelor 25-30 kcal/kg greutate corporală x zi), proteine 1,3-2,0 g/(kg greutate corporală x zi), dipeptide de glutamină 0,3-0,4 g/(kg x zi), glucoză - 30-70% din caloriile neproteice, cu condiția ca glicemia să fie menținută <6,1 mmol/l, grăsimi - 15-50% din caloriile neproteice.

