Noile publicații
Proteină cheie identificată pentru a preveni pierderea masei osoase în osteoporoză
Ultima examinare: 02.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
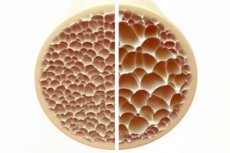
Osteoporoza, o afecțiune caracterizată prin oase poroase și fragile, reprezintă o amenințare semnificativă pentru sănătatea scheletică. Oasele, ca principal suport structural al corpului uman, oferă un suport vital. Atunci când masa osoasă scade, nu numai că afectează acest suport, dar afectează și funcția generală, ducând la o scădere a calității vieții.
Pe măsură ce incidența osteoporozei crește în rândul populației îmbătrânite, există o povară tot mai mare asupra resurselor de asistență medicală pentru îngrijirea pe termen lung. Prin urmare, este necesar să se înțeleagă mecanismele care contribuie la dezvoltarea osteoporozei și să se dezvolte tratamente eficiente și specifice pentru a minimiza impactul acesteia pe termen lung.
Osteoblastele și osteoclastele sunt două tipuri de celule care joacă un rol cheie în menținerea și remodelarea țesutului osos. În timp ce osteoblastele sunt celule formatoare de os, responsabile de sinteza și depunerea de țesut osos nou, osteoclastele sunt celule care degradează osul, implicate în descompunerea și îndepărtarea țesutului osos vechi sau deteriorat.
O creștere a proporției de osteoclaste duce la pierderea osoasă în afecțiuni precum osteoporoza, artrita reumatoidă (inflamația articulațiilor) și metastazele osoase (cancer care s-a răspândit la oase). Osteoclastele apar din diferențierea macrofagelor sau monocitelor, care sunt tipuri de celule imune.
Astfel, inhibarea diferențierii osteoclastelor poate servi ca strategie terapeutică pentru prevenirea pierderii osoase. Cu toate acestea, mecanismele moleculare precise care reglează procesul complex de remodelare osoasă rămân neclare.
Într-un nou studiu, profesorul Tadayoshi Hayata, dl. Takuto Konno și dna Hitomi Murachi de la Universitatea de Științe din Tokyo, împreună cu colegii săi, au aprofundat reglarea moleculară a diferențierii osteoclastelor. Stimularea cu ligandul activator al receptorului factorului nuclear kappa B (RANKL) induce diferențierea macrofagelor în osteoclaste.
În plus, căile de semnalizare ale proteinei morfogenetice osoase (BMP) și factorului de creștere transformant (TGF)-β au fost implicate în reglarea diferențierii osteoclastelor mediate de RANKL. În studiul actual, cercetătorii și-au propus să investigheze rolul Ctdnep1, o fosfatază (o enzimă care îndepărtează grupările fosfat) despre care s-a raportat că suprimă căile de semnalizare BMP și TGF-β.
Studiul este publicat în revista Biochemical and Biophysical Research Communications.
Profesorul Hayata afirmă: „RANKL acționează ca un «accelerator» pentru diferențierea osteoclastelor. Condusul unei mașini necesită nu doar un accelerator, ci și frâne. Aici, am descoperit că Ctdnep1 acționează ca o «frână» în diferențierea osteoclastelor.”
Cercetătorii au examinat mai întâi expresia Ctdnep1 în macrofagele de șoarece tratate cu RANKL și în celulele de control netratate. Aceștia au observat că expresia Ctdnep1 nu s-a modificat ca răspuns la stimularea cu RANKL. Cu toate acestea, aceasta a fost localizată în citoplasmă sub formă granulară în macrofage și diferențiată în osteoclaste, distinctă de localizarea sa perinucleară normală în alte tipuri de celule, indicând funcția sa citoplasmatică în diferențierea osteoclastelor.
Mai mult, reducerea expresiei genelor la Ctdnep1 (inhibarea expresiei genelor) a dus la o creștere a numărului de osteoclaste pozitive pentru fosfataza acidă rezistentă la tartrat (TRAP), unde TRAP este un marker al osteoclastelor diferențiate.
Eliminarea genei Ctdnep1 a dus la creșterea expresiei markerilor cheie de diferențiere, inclusiv „Nfatc1”, un factor de transcripție principal indus de RANKL pentru diferențierea osteoclastelor. Aceste rezultate susțin o „funcție de frânare” a Ctdnep1, prin care reglează negativ diferențierea osteoclastelor. Mai mult, eliminarea genei Ctdnep1 a dus, de asemenea, la creșterea absorbției fosfatului de calciu, sugerând un rol supresor al Ctdnep1 în resorbția osoasă.
În cele din urmă, deși eliminarea Ctdnep1 nu a modificat semnalizarea BMP și TGF-β, celulele cu deficit de Ctdnep1 au prezentat niveluri crescute de proteine fosforilate (activate), care sunt produse ale căii de semnalizare RANKL. Aceste rezultate sugerează că efectul inhibitor al Ctdnep1 asupra diferențierii osteoclastelor ar putea să nu fie mediat prin semnalizarea BMP și TGF-β, ci prin reglarea negativă a căii de semnalizare RANKL și a nivelurilor de proteine Nfatc1.
Per ansamblu, aceste rezultate oferă noi perspective asupra procesului de diferențiere a osteoclastelor și identifică potențiale ținte terapeutice care ar putea fi utilizate pentru a dezvolta tratamente pentru reducerea pierderii osoase cauzate de hiperactivitatea osteoclastelor. Pe lângă bolile caracterizate prin pierdere osoasă, Ctdnep1 a fost identificată și ca factor cauzal în meduloblastom, o tumoare cerebrală la copii. Autorii sunt optimiști că cercetarea lor poate fi extinsă la alte boli umane dincolo de metabolismul osos.
Profesorul Hayata concluzionează: „Rezultatele noastre sugerează că Ctdnep1 este necesar pentru a preveni osteoclastogeneza excesivă. Aceste rezultate ne pot extinde cunoștințele despre modul în care rețeaua de fosforilare-defosforilare controlează diferențierea osteoclastelor și pot oferi noi strategii terapeutice pentru tratamentul bolilor osoase asociate cu activitatea excesivă a osteoclastelor.”
