Noile publicații
Medicamentul LM11A-31 încetinește progresia bolii Alzheimer în cadrul unui studiu
Ultima examinare: 02.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.

Într-un studiu recent publicat în revista Nature Medicine, oamenii de știință au efectuat un studiu randomizat, dublu-orb, controlat cu placebo, de fază 2a, pentru a examina siguranța și eficacitatea LM11A-31 în tratamentul bolii Alzheimer (BA) prin modularea receptorului de neurotrofină p75 (p75NTR).
Boala Alzheimer cu debut tardiv este cea mai frecventă formă de demență, caracterizată prin insuficiență sinaptică, degenerare și pierderea celulelor nervoase. Deși cele două medicamente principale pentru tratamentul bolii Alzheimer vizează acumularea de proteine amiloid-β sau tau anormale, ele abordează doar o parte a fiziopatologiei. O altă abordare implică țintirea receptorilor și a rețelelor de semnalizare care influențează căile biologice fundamentale. Studiile preclinice arată că modularea p75NTR cu o nouă moleculă chimică mică, LM11A-31, reduce pierderea sinaptică cauzată de amiloid și tau anormal.
Descrierea studiului
În acest studiu clinic randomizat, cercetătorii au examinat dacă LM11A-31 ar putea încetini progresia bolii Alzheimer prin modularea p75NTR la om.
Participanților la studiu li s-au administrat capsule orale LM11A-31 în doze de 200 mg și 400 mg sau placebo într-un raport de 1:1:1 la 242 de pacienți cu astm ușor până la moderat, timp de 26 de săptămâni. Participanții aveau boala Alzheimer confirmată biologic (nivelul proteinei β amiloide 42 (Aβ42) în lichidul cefalorahidian sub 550 ng/l sau raportul Aβ42:β40 sub 0,89), diagnosticată conform criteriilor McKhann, cu scoruri Mini-Psychiatric Examination (MMSE) de 18 până la 26, scoruri Geriatric Depression Scale (GDS) sub 5,0, scoruri Hachinski Ischemic Scale modificate (HIS) ≤ 4,0, educație formală ≥ 8 ani și declin cognitiv anterior ≥ 6 luni.
Participanții eligibili luaseră inhibitori de acetilcolinesterază (AChEI) sau antagoniști parțiali ai receptorilor NMDA timp de ≥ 3 luni înainte de intrarea în studiu. Nu luaseră droguri ilicite, cum ar fi antipsihotice, benzodiazepine, medicamente antiepileptice, sedative, antihipertensive cu acțiune centrală, nootropice (cu excepția ginkgo biloba) sau analgezice care conțin opioide.
Criteriul principal de evaluare a studiului a fost siguranța și tolerabilitatea, evaluate folosind Scala Columbia de Evaluare a Severității Gândurilor și Comportamentului Suicidar (C-SSRS), semnele vitale, tensiunea arterială și parametrii hematologici. Imagistica prin rezonanță magnetică structurală (IRMc), tomografia cu emisie de pozitroni cu fluorodeoxiglucoză (FDG-PET) și biomarkerii din lichidul cefalorahidian (LCR) au fost utilizați pentru a evalua rezultatele cognitive secundare. Măsurătorile DA au inclus tau fosforilat cu Thr181, proteina tau totală, Aβ40, Aβ42 și activitatea AChE. Echipa a utilizat un test neuropsihologic personalizat pentru a evalua rezultatele cognitive secundare la momentul inițial, în săptămânile 12 și 26.
Rezultatele cercetării
Studiul a constatat că LM11A-31 este sigur și bine tolerat, fără probleme semnificative de siguranță. Cele mai frecvente evenimente adverse au inclus cefalee, diaree, eozinofilie și nazofaringită, problemele gastrointestinale și eozinofilie fiind principalele motive pentru întreruperea tratamentului. Au existat mai multe întreruperi în grupul de 400 mg comparativ cu grupurile de 200 mg și placebo. RMN-ul nu a evidențiat probleme de siguranță, inclusiv anomalii legate de amiloid. Nu au existat diferențe semnificative în ceea ce privește scorurile cognitive sau anomaliile amiloide între cele două grupuri de tratament.
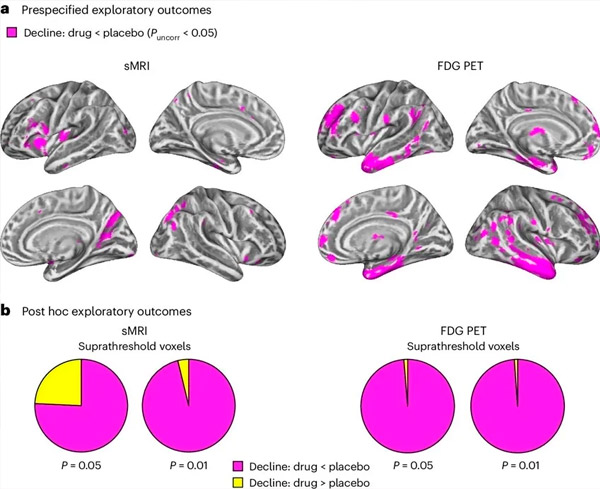
A. Analiza covarianței cu modele mixte bidirecționale a examinat interacțiunile dintre tratament (medicament sau placebo) și timp (înainte sau după tratament). O analiză t unidirecțională a ipotezei interacțiunii (medicamentul încetinește progresia în comparație cu placebo) a arătat că tratamentul cu LM11A-31 a încetinit degenerarea longitudinală (panourile din stânga) și hipometabolismul glucozei (panourile din dreapta) în grupul tratat cu medicament (cMRI, n = 127; PET, n = 121) comparativ cu grupul placebo (cMRI, n = 66; PET, n = 62). Voxelii care prezintă această interacțiune sunt arătați la un prag necorectat de P < 0,05 (magenta) pe o suprafață corticală specifică populației. Emisferele stânga și dreaptă sunt arătate în rândurile de sus și respectiv de jos. Regiunile creierului care prezintă interacțiuni inconsistente cu ipoteza sunt prezentate în Figura 7 din Datele suplimentare.
B. Numărul total de voxeli din regiunile cerebrale vulnerabile predefinite pentru boala Alzheimer (suprafața totală a diagramelor circulare) care prezintă fie o interacțiune în conformitate cu ipoteza (magenta), fie o interacțiune inconsistentă cu ipoteza (galben) în fiecare modalitate de imagistică (RMNc, panoul stâng; PET FDG, panoul drept) la praguri din ce în ce mai liberale de P < 0,01 și P < 0,05 necorectate. Simulările Monte Carlo au arătat că raporturile dintre voxelii care prezintă efecte în conformitate cu ipoteza față de cei inconsistenti cu ipoteza au fost semnificativ mai mari decât cele observate pe baza datelor generate aleatoriu atât pentru RMNcc, cât și pentru PET (P < 0,001 pentru fiecare modalitate; test bilateral).
LM11A-31 a redus eficient creșterea nivelului de Aβ42 și Aβ40 în LCR în comparație cu grupul placebo. Medicamentul a demonstrat, de asemenea, o reducere a modificării procentuale anuale medii a biomarkerului proteic presinaptic SNAP25 și o scădere a biomarkerului postsinaptic NG, indicând o încetinire a pierderii conexiunilor presinaptice și postsinaptice. LM11A-31 a redus, de asemenea, creșterea nivelului de YKL40, ducând la o scădere a scorurilor MMSE și o creștere a scorurilor ADAS-Cog-13. Medicamentul a redus, de asemenea, pierderea de substanță cenușie în lobul frontal și cortexul parietal posterior și o scădere a metabolismului glucozei în zone precum cortexul entorinal, cortexul temporal, hipocampusul, cortexul insular și cortexul prefrontal.
Concluzie
Studiul a concluzionat că modularea p75NTR de către LM11A-31 este potrivită pentru studii clinice mai ample. LM11A-31 a îndeplinit criteriul principal de evaluare a siguranței și a fost bine tolerat la pacienții cu Alzheimer ușor până la sever. Rezultatele indică necesitatea unor studii suplimentare cu durate de tratament mai lungi pentru a evalua potențialul moleculelor mici de a regla p75NTR ca terapie modificatoare a bolii în Alzheimer. Studiul a arătat că LM11A-31 a afectat semnificativ mai mulți biomarkeri, inclusiv Aβ40, Aβ42, SNAP25, NG și YKL40, indicând o încetinire a progresiei patologice. Studiile viitoare ar putea evalua indicatori suplimentari ai sănătății gliale.
