Noile publicații
Mutația genei ARID1A face tumorile sensibile la imunoterapie
Ultima examinare: 02.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Imunoterapia a revoluționat tratamentul cancerului în ultimii ani. În loc să vizeze direct tumorile, imunoterapia direcționează sistemul imunitar al pacienților să atace tumorile mai eficient. Acest lucru este deosebit de eficient pentru unele tipuri de cancer greu de tratat. Cu toate acestea, mai puțin de jumătate dintre pacienții cu cancer răspund la imunoterapiile actuale, ceea ce creează o nevoie urgentă de a identifica biomarkeri care pot prezice care pacienți sunt cel mai probabil să beneficieze de tratament.
Recent, oamenii de știință au observat că pacienții ale căror tumori au o mutație în gena ARID1A sunt mai predispuși să răspundă pozitiv la blocarea punctelor de control imun, un tip de imunoterapie care funcționează prin menținerea activate a celulelor imune care luptă împotriva cancerului.
Deoarece mutația genei ARID1A este prezentă în multe tipuri de cancer, inclusiv cancerul endometrial, ovarian, colorectal, gastric, hepatic și pancreatic, cercetătorii de la Institutul Salk s-au întrebat cum ar putea contribui aceasta la sensibilitatea tratamentului și cum ar putea medicii să utilizeze aceste informații pentru a personaliza tratamentul împotriva cancerului pentru fiecare pacient.
Noul lor studiu, publicat în revista Cell, arată că mutația ARID1A face tumorile sensibile la imunoterapie prin recrutarea de celule imune care combat cancerul la nivelul tumorii printr-un răspuns imun asemănător antiviralului.
Cercetătorii sugerează că această mutație și răspunsul imun antiviral ar putea fi utilizate ca biomarker pentru o mai bună selectare a pacienților pentru imunoterapii specifice, cum ar fi blocarea punctelor de control imun. Aceste descoperiri încurajează, de asemenea, dezvoltarea de medicamente care vizează ARID1A și proteinele înrudite pentru a face alte tumori mai sensibile la imunoterapie.
„Acest lucru ar putea schimba cu adevărat rezultatul tratamentului împotriva cancerului pentru pacienți”, a declarat profesorul asociat Diana Hargreaves, autoarea principală a studiului. „Pacienții cu mutația ARID1A au deja un răspuns imun, așa că tot ce trebuie să facem este să stimulăm acest răspuns cu blocarea punctelor de control imun pentru a-i ajuta să-și distrugă tumorile din interior.”
Deși se știa că persoanele cu mutații ARID1A răspundeau bine la blocarea punctelor de control imunitar, legătura exactă dintre cele două a rămas neclară. Pentru a clarifica mecanismul, oamenii de știință de la Institutul Salk au folosit modele murine de melanom și cancer colorectal, atât cu mutația ARID1A, cât și cu ARID1A funcțional.
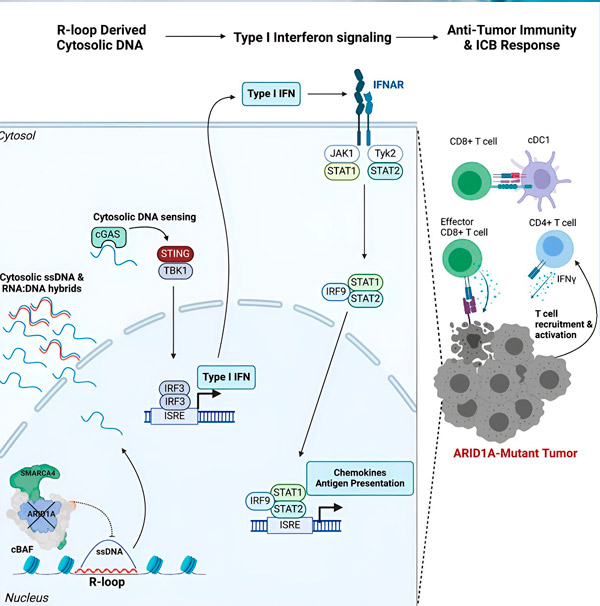
Sursă: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Echipa a observat un răspuns imun robust în toate modelele cu mutația ARID1A, dar nu și în cele în care ARID1A era funcțională, ceea ce susține ideea că mutația ARID1A este într-adevăr cea care determină acest răspuns. Dar cum funcționează acest lucru la nivel molecular?
„Am descoperit că ARID1A joacă un rol important în nucleu prin menținerea unei organizări corecte a ADN-ului”, spune Matthew Maxwell, primul autor al studiului și student absolvent în laboratorul Hargreaves. „Fără ARID1A funcțional, ADN-ul liber poate fi excizat și eliberat în citosol, activând un răspuns imun antiviral dorit, care poate fi amplificat prin blocarea punctelor de control imun.”
Gena ARID1A codifică o proteină ce ajută la reglarea formei ADN-ului nostru și la menținerea stabilității genomului. Atunci când ARID1A suferă o mutație, aceasta declanșează un lanț de evenimente asemănător cu cel al genei Rube Goldberg în celulele canceroase.
În primul rând, lipsa genei ARID1A funcționale duce la eliberarea de ADN în citosol. ADN-ul citosolic activează apoi un sistem de alarmă antiviral, calea cGAS-STING, deoarece celulele noastre sunt adaptate să marcheze orice ADN din citosol ca fiind străin pentru a se proteja împotriva infecțiilor virale. În cele din urmă, calea cGAS-STING angajează sistemul imunitar pentru a recruta celule T în tumoare și a le activa în celule T specializate care distrug cancerul.
La fiecare etapă, în funcție de cea anterioară, acest lanț de evenimente - mutația ARID1A, evadarea ADN-ului, alarma cGAS-STING, recrutarea celulelor T - duce la o creștere a numărului de celule T care luptă împotriva cancerului în tumoră. Blocarea punctelor de control imunitar poate fi apoi utilizată pentru a se asigura că aceste celule T rămân activate, sporindu-le capacitatea de a învinge cancerul.
„Descoperirile noastre oferă un nou mecanism molecular prin care o mutație ARID1A poate contribui la un răspuns imun antitumoral”, spune Hargreaves. „Ceea ce este interesant la aceste descoperiri este potențialul lor translațional. Putem folosi mutațiile ARID1A pentru a selecta pacienții pentru blocarea punctelor de control imun, iar acum vedem un mecanism prin care medicamentele care inhibă ARID1A sau complexul său proteic ar putea fi utilizate pentru a îmbunătăți și mai mult imunoterapia la alți pacienți.”
Prin descrierea mecanismului prin care blocarea punctelor de control imunitar este mai eficientă în cancerele cu mutație ARID1A, cercetătorii oferă medicilor o justificare pentru prioritizarea acestei imunoterapii la pacienții cu o mutație ARID1A. Aceste descoperiri reprezintă un pas important către personalizarea tratamentului împotriva cancerului și inspiră dezvoltarea de noi terapii care vizează ARID1A și complexul său proteic.
Pe viitor, echipa Institutului Salk speră că descoperirile lor vor îmbunătăți rezultatele tratamentului pentru pacienții cu diferite tipuri de cancer asociate cu mutații ARID1A și intenționează să exploreze această traducere clinică în colaborare cu Universitatea din California, San Diego.
