Noile publicații
Mecanismele genetice noi ar putea fi o țintă terapeutică împotriva gliomului
Ultima examinare: 02.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Un studiu realizat de laboratorul doctorului Shi-Yuan Cheng, profesor în cadrul Diviziei de Neuro-Oncologie Ken și Ruth Davey din cadrul Departamentului de Neurologie, a identificat noi mecanisme care stau la baza evenimentelor alternative de splicing al ARN-ului în celulele tumorale ale gliomului, care ar putea servi drept noi ținte terapeutice. Rezultatele studiului sunt publicate în Journal of Clinical Investigation.
„Am găsit o modalitate diferită de a trata gliomul prin prisma splicingului alternativ și am descoperit noi ținte care nu au fost identificate anterior, dar sunt importante pentru malignitatea gliomului”, a declarat Xiao Song, MD, PhD, profesor asociat de neurologie și autor principal al studiului.
Glioamele sunt cel mai frecvent tip de tumoră cerebrală primară la adulți și provin din celulele gliale, care se află în sistemul nervos central și susțin neuronii vecini. Glioamele sunt foarte rezistente la tratamentele standard, inclusiv radioterapia și chimioterapia, din cauza heterogenității genetice și epigenetice a tumorii, subliniind necesitatea găsirii de noi ținte terapeutice.
Cercetări anterioare ale laboratorului Cheng, publicate în revista Cancer Research, au arătat că importantul factor de splicing SRSF3 este semnificativ crescut în glioame în comparație cu creierul normal, iar splicing-ul ARN reglat de SRSF3 promovează creșterea și progresia gliomului prin influențarea multiplelor procese celulare din celulele tumorale.
Splicing-ul ARN este un proces care implică îndepărtarea intronilor (regiuni necodificatoare ale ARN-ului) și unirea exonilor (regiuni codificatoare) pentru a forma o moleculă de ARNm matură ce susține exprimarea genelor într-o celulă.
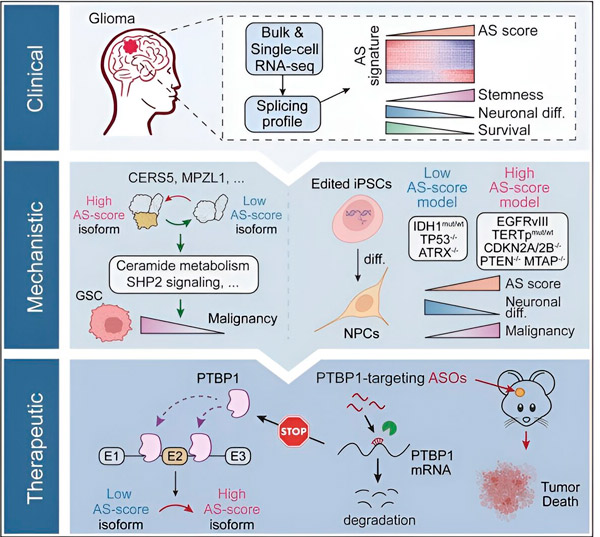
În prezentul studiu, oamenii de știință și-au propus să identifice modificările splicingului alternativ în celulele tumorale ale gliomului, mecanismele care stau la baza acestor modificări și să determine potențialul lor ca ținte terapeutice.
Folosind metode computaționale și tehnologii de secvențiere a ARN-ului, cercetătorii au examinat modificările de splicing în celulele tumorale ale gliomului din probele pacienților. Pentru a confirma aceste modificări, au folosit tehnologiile de editare genetică CRISPR pentru a introduce diferite mutații driver ale gliomului în modele de gliom derivate din celule stem pluripotente induse umane (iPSC).
Ei au descoperit că aceste modificări de splicing sunt amplificate de o variantă a receptorului III al factorului de creștere epidermală (EGFRIII), despre care se știe că este supraexprimat în multe tumori, inclusiv glioame, și sunt inhibate de o mutație a genei IDH1.
Cercetătorii au confirmat funcția a două evenimente de splicing ale ARN-ului care creează izoforme proteice diferite cu secvențe de aminoacizi diferite.
„Doar una dintre aceste izoforme poate promova creșterea tumorii, spre deosebire de cealaltă izoformă, care este exprimată în mod normal în creierul normal. Tumorile exploatează acest mecanism pentru a exprima selectiv izoforma care promovează tumora față de izoforma creierului normal”, a spus Song.
Echipa a analizat apoi proteinele din amonte care leagă ARN-ul și a descoperit că gena PTBP1 reglează splicing-ul ARN-ului care promovează tumora în celulele gliomului. Folosind un model ortotopic de gliom la șoareci imunodeficienți, cercetătorii au vizat PTBP1 cu o terapie bazată pe oligonucleotide antisens (ASO), care în cele din urmă a suprimat creșterea tumorii.
„Datele noastre evidențiază rolul splicingului alternativ al ARN-ului în influențarea malignității și eterogenității gliomului și potențialul său ca vulnerabilitate terapeutică pentru tratamentul glioamelor adulte”, au scris autorii studiului.
Următorul pas pentru cercetători este să exploreze potențialul țintirii PTBP1 pentru a provoca un răspuns imun antitumoral, a spus Song.
„Folosind analiza secvențierii ARN de citire lungă, am descoperit că direcționarea PTBP1 în celulele gliomului are ca rezultat producerea mai multor transcrieri îmbinate alternativ, care sunt absente în țesuturile normale. Așadar, următorul nostru proiect este de a afla dacă această izoformă poate genera anumiți antigeni, astfel încât sistemul imunitar să poată recunoaște mai bine tumora”, a spus Song.
Song a adăugat, de asemenea, că echipa lor este interesată de analizarea modificărilor de splicing în celulele non-tumorale de la pacienții cu gliom, cum ar fi celulele imune.
„Știm deja că splicing-ul este foarte important pentru reglarea funcției în celulă, așa că nu ar trebui să regleze doar malignitatea tumorii, ci poate regla și funcția celulelor imune pentru a determina dacă acestea pot distruge eficient cancerul. Așadar, facem și niște analize bioinformatice în celule imune infiltrate în tumoră pentru a vedea dacă există o modificare a splicing-ului după ce o celulă imună s-a infiltrat în tumoare.”
„Scopul nostru este de a determina rolul splicingului alternativ în modelarea micromediului tumoral imunosupresor și de a identifica potențiale ținte pentru îmbunătățirea eficacității imunoterapiilor în glioamă”, a spus Song.
