Noile publicații
Proteina responsabilă pentru boala inflamatorie genetică identificată
Ultima examinare: 02.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
O echipă de cercetători condusă de Dr. Hirotsugu Oda de la Clusterul de Excelență pentru Cercetarea Îmbătrânirii CECAD de la Universitatea din Köln a descoperit rolul pe care îl joacă un anumit complex proteic în unele forme de disfuncție imunitară. Acest rezultat ar putea duce la dezvoltarea de noi abordări terapeutice care vizează reducerea autoinflației și „restaurarea” sistemului imunitar al pacienților care suferă de o disfuncție genetică a acestui complex proteic.
Studiul, intitulat „Pierderea funcției genei SHARPIN bialelice umane induce autoinflamație și imunodeficiență”, a fost publicat în revista Nature Immunology.
Complexul liniar de asamblare a ubiquitinei (LUBAC), compus din proteinele HOIP, HOIL-1 și SHARPIN, este recunoscut de mult timp pentru rolul său esențial în menținerea homeostaziei imune. Studiile anterioare efectuate pe șoareci au arătat consecințele severe ale pierderii SHARPIN, ducând la dermatită severă din cauza morții excesive a celulelor pielii. Cu toate acestea, consecințele specifice asupra sănătății ale deficitului de SHARPIN la om au rămas neclare.
Echipa de cercetare a raportat pentru prima dată două persoane cu deficit de SHARPIN care prezintă simptome de autoinflație și imunodeficiență, dar în mod neașteptat nu prezintă probleme dermatologice așa cum au apărut la șoareci.
În urma unor investigații suplimentare, s-a constatat că acești indivizi prezintă un răspuns canonic NF-κB afectat, o cale importantă de răspuns imun. De asemenea, au prezentat o susceptibilitate crescută la moartea celulară indusă de membrii superfamiliei factorului de necroză tumorală (TNF). Tratamentul unui pacient cu deficit de SHARPIN cu terapie anti-TNF, care inhibă în mod specific moartea celulară indusă de TNF, a dus la rezoluția completă a autoinflației la nivel celular și la prezentarea clinică.
Studiul arată că moartea celulară excesivă și necontrolată joacă un rol esențial în bolile inflamatorii genetice umane. Echipa lui Oda a adăugat deficiența SHARPIN ca nou membru al unui grup de boli inflamatorii genetice umane pe care propun să le numească „erori congenitale ale morții celulare”.
Protecție împotriva disfuncției imune Studiul a fost inițiat în laboratorul Dr. Dan Kastner de la Institutele Naționale de Sănătate (NIH) din Statele Unite. Oamenii de știință de acolo au avut ocazia să observe un pacient cu episoade inexplicabile de febră, artrită, colită și imunodeficiență cu debut în copilărie.
După obținerea consimțământului informat, au efectuat secvențierea exomului pacientului și a membrilor familiei sale și au descoperit că pacientul avea o variantă genetică devastatoare în gena SHARPIN, care a dus la niveluri nedetectabile ale proteinei SHARPIN. De asemenea, au descoperit că celulele pacientului au prezentat o predispoziție crescută la moarte atât în celulele cultivate, cât și în biopsiile pacientului.
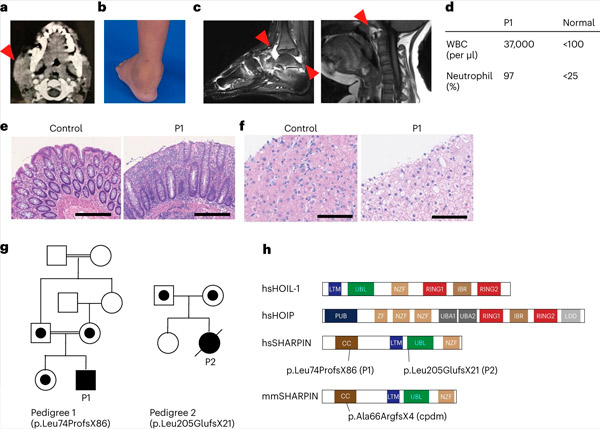
Deficitul de SHARPIN la om provoacă autoinflamație și glicogenoză hepatică. Sursa: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Echipa a descoperit, de asemenea, că dezvoltarea centrelor germinale limfoide – microstructuri specializate în adenoide, esențiale pentru maturarea celulelor B ale sistemului nostru imunitar și, prin urmare, pentru producerea de anticorpi – a fost semnificativ redusă din cauza creșterii mortalității celulelor B. Aceste descoperiri explică imunodeficiența pacienților și evidențiază rolul important al LUBAC în menținerea homeostaziei imune la om.
„Studiul nostru evidențiază importanța critică a LUBAC în protejarea împotriva disreglării imune. Prin elucidarea mecanismelor moleculare care stau la baza deficitului de LUBAC, deschidem calea pentru noi strategii terapeutice care vizează restabilirea homeostaziei imune”, a declarat Oda, autorul principal al studiului.
El a adăugat: „Unul dintre pacienții cu deficit de SHARPIN fusese imobilizat în scaun cu rotile ani de zile înainte să-l vedem pentru prima dată. Gleznele îi erau inflamate și era prea dureros să meargă. Diagnosticul genetic ne-a permis să țintim calea moleculară corectă care stă la baza afecțiunilor sale.”
De când pacientul a început să primească terapie anti-TNF, acesta nu a mai prezentat simptome timp de aproape șapte ani. „În calitate de clinician și om de știință, mă bucur să am oportunitatea de a avea un impact pozitiv asupra vieții unui pacient prin intermediul cercetării noastre”, a concluzionat Oda.
