Noile publicații
Boala celiacă: noi dovezi privind efectele glutenului
Ultima examinare: 02.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.

Astăzi este Ziua Mondială a Boalei Celiace. Boala celiacă este o boală autoimună cronică care afectează aproximativ 1% din populația lumii. Este cauzată de consumul de proteine din gluten din grâu, orz, secară și unele tipuri de ovăz. O dietă fără gluten protejează pacienții cu boală celiacă de leziuni intestinale grave.
Împreună cu colegii săi, chimista Dr. Veronica Dodero de la Universitatea din Bielefeld a reușit să determine noi detalii despre modul în care anumite molecule derivate din gluten cauzează sindromul intestinului permeabil în boala celiacă.
Principala constatare a studiului: un anumit fragment de proteine produs în boala celiacă activă formează nanostructuri numite oligomeri și se acumulează în celulele epiteliale intestinale model. Denumirea tehnică pentru această moleculă este peptida gliadină deamidată 33-mer (DGP). Echipa de cercetare a descoperit că prezența oligomerilor DGP poate deschide mucoasa intestinului, ducând la sindromul de intestin permeabil.
Studiul a fost publicat în revista Angewandte Chemie International Edition.
Peptidele de grâu care cauzează permeabilitate intestinală
Când mâncăm grâu, organismul nostru nu este capabil să descompună complet proteinele glutenului. Acest lucru poate duce la formarea de fragmente mari de gluten (peptide) în intestine. În cazurile de boală celiacă activă, cercetătorii au descoperit că o enzimă numită transglutaminază tisulară 2 (tTG2), prezentă la oameni, modifică o peptidă specifică a glutenului, rezultând formarea de DGP 33-mer. Acest lucru se întâmplă de obicei într-o parte a intestinelor noastre numită lamina propria. Cu toate acestea, studii recente au arătat că acest proces poate avea loc și în mucoasa intestinală.
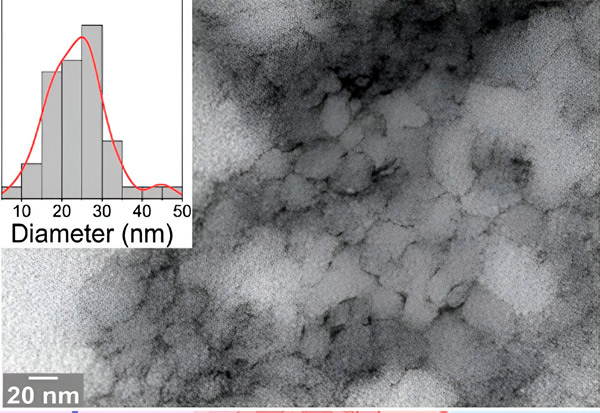
O micrografie electronică din studiu arată peptida problematică DGP de 33 de meruri cu structuri ascuțite care pot deschide bariera intestinală. Sursa: Universitatea Bielefeld
„Echipa noastră interdisciplinară a caracterizat formarea oligomerilor DGP de 33 de meruri folosind microscopie de înaltă rezoluție și metode biofizice. Am constatat o permeabilitate crescută într-un model de celule intestinale la acumularea de DGP”, a declarat Dr. Maria Georgina Herrera, prima autoare a studiului. Este cercetătoare la Universitatea din Buenos Aires, Argentina, și a fost cercetătoare postdoctorală la Universitatea din Bielefeld.
Când bariera intestinală este perturbată
Sindromul intestinului permeabil apare atunci când mucoasa intestinală devine permeabilă, permițând substanțelor nocive să pătrundă în fluxul sanguin, ducând la răspunsuri inflamatorii și diverse boli. În cazul bolii celiace, există dezbateri despre etapele incipiente ale permeabilității crescute. Teoria principală este că inflamația cronică în boala celiacă duce la intestin permeabil.
Totuși, există o a doua teorie care sugerează că efectele glutenului asupra celulelor mucoasei intestinale sunt cauza principală. Conform acestei teorii, glutenul deteriorează direct celulele mucoasei intestinale, făcându-le permeabile, provocând inflamație cronică și putând duce la boala celiacă la persoanele susceptibile.
Totuși, din moment ce glutenul este consumat zilnic, care sunt factorii moleculari declanșatori care duc la permeabilitatea intestinală la pacienții cu boală celiacă? Dacă se formează oligomeri de 33-mer DGP, aceștia pot deteriora rețeaua celulară epitelială, permițând peptidelor glutenului, bacteriilor și altor toxine să pătrundă în masă în fluxul sanguin, ducând la inflamație și, în cazul bolii celiace, la un răspuns autoimun.
„Descoperirile noastre întăresc ipoteza medicală conform căreia perturbarea barierei epiteliale cauzată de peptidele glutenului este cauza și nu rezultatul răspunsului imun la pacienții cu boală celiacă”, spune autoarea principală, Dr. Veronica Dodero, de la Departamentul de Chimie al Universității Bielefeld.
Legătura dintre DGP 33-mer și boala celiacă
Antigenele leucocitare umane (HLA) sunt proteine care se găsesc la suprafața celulelor din organism. Acestea joacă un rol important în sistemul imunitar, ajutându-l să distingă între celulele proprii și substanțele străine, cum ar fi bacteriile sau virusurile.
În cazul bolii celiace, două proteine HLA specifice, și anume HLA-DQ2 și HLA-DQ8, sunt puternic asociate cu boala. DGP-ul de 33 de meruri se potrivește perfect cu HLA-DQ2 sau HLA-DQ8 și declanșează un răspuns imun care duce la inflamația și atrofia vilozităților intestinului subțire. Această interacțiune puternică transformă DGP-ul în ceea ce oamenii de știință numesc un superantigen. Pentru cei care suferă de boala celiacă, o dietă fără gluten este singura terapie pe tot parcursul vieții.
