Noile publicații
Oamenii de știință au creat un compus "cameleonic" pentru tratarea cancerelor cerebrale rezistente la medicamente
Ultima examinare: 02.07.2025

Tot conținutul iLive este revizuit din punct de vedere medical sau verificat pentru a vă asigura cât mai multă precizie de fapt.
Avem linii directoare de aprovizionare stricte și legătura numai cu site-uri cu reputație media, instituții de cercetare academică și, ori de câte ori este posibil, studii medicale revizuite de experți. Rețineți că numerele din paranteze ([1], [2], etc.) sunt link-uri clickabile la aceste studii.
Dacă considerați că oricare dintre conținuturile noastre este inexactă, depășită sau îndoielnică, selectați-o și apăsați pe Ctrl + Enter.
Un nou studiu realizat de oamenii de știință de la Universitatea Yale descrie modul în care un nou compus chimic atacă tumorile cerebrale rezistente la medicamente fără a deteriora țesutul sănătos din jur.
Studiul, publicat în Journal of the American Chemical Society, reprezintă un pas important în dezvoltarea așa-numiților „compuși cameleonici” care ar putea fi utilizați pentru a combate o serie de tipuri de cancer periculoase.
Glioamele se dezvoltă la aproximativ 6,6 la 100.000 de persoane în fiecare an și la 2,94 la 100.000 de persoane până la vârsta de 14 ani. Excluzând metastazele altor tipuri de cancer care ajung la sistemul nervos central, glioamele reprezintă 26% din totalul tumorilor cerebrale (tumorile cerebrale primare) și 81% din totalul tumorilor cerebrale maligne.
Timp de decenii, pacienții cu glioblastom au fost tratați cu un medicament numit temozolomidă. Cu toate acestea, majoritatea pacienților dezvoltă rezistență la temozolomidă în decurs de un an. Rata de supraviețuire la cinci ani pentru pacienții cu glioblastom este mai mică de 5%.
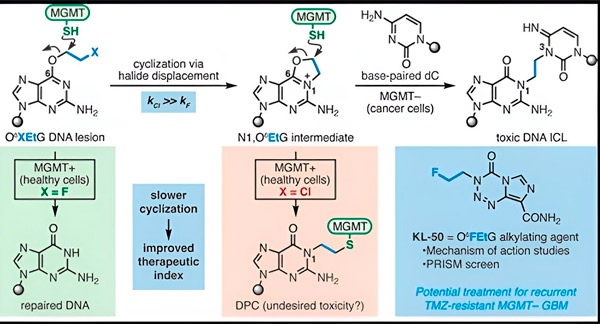
În 2022, chimistul Seth Herzon de la Yale și oncologul radioterapeut Dr. Ranjit Bindra au dezvoltat o nouă strategie pentru a trata glioblastoamele mai eficient. Aceștia au creat o clasă de molecule anticancerigene numite compuși cameleon, care exploatează un defect al unei proteine de reparare a ADN-ului, cunoscută sub numele de O6-metilguanin ADN metiltransferază (MGMT).
Multe celule canceroase, inclusiv glioblastoamele, nu au proteina MGMT. Noii compuși cameleon sunt concepuți pentru a deteriora ADN-ul din celulele tumorale cărora le lipsește MGMT.
Compușii cameleonici inițiază deteriorarea ADN-ului prin depunerea de leziuni primare pe ADN, care în timp evoluează în leziuni secundare extrem de toxice, cunoscute sub numele de legături intercatenare. MGMT protejează ADN-ul țesuturilor sănătoase prin repararea leziunilor primare înainte ca acestea să poată evolua în legături intercatenare mortale.
Pentru noul lor studiu, coautorii Herzon și Bindra s-au concentrat pe principalul lor cameleon, KL-50.
„Am folosit o combinație de studii de chimie sintetică și biologie moleculară pentru a elucida baza moleculară a observațiilor noastre anterioare, precum și cinetica chimică ce asigură selectivitatea unică a acestor compuși”, a declarat Herzon, profesorul de chimie Milton Harris de la Yale. „Am demonstrat că KL-50 este unic prin faptul că formează legături încrucișate ale ADN-ului doar în tumorile cu reparare defectuoasă a ADN-ului. Cruță țesutul sănătos.”
Sursa: Jurnalul Societății Americane de Chimie (2024). DOI: 10.1021/jacs.3c06483
Aceasta este o diferență semnificativă, subliniază cercetătorii. O serie de alți compuși anticancerigeni au fost concepuți pentru a declanșa legături încrucișate între catene, dar aceștia nu sunt selectivi pentru celulele tumorale, ceea ce le limitează utilitatea.
Secretul succesului KL-50 constă în sincronizarea sa, au remarcat cercetătorii. KL-50 formează legături încrucișate intercatenare mai lent decât alți agenți de reticulare. Această întârziere oferă celulelor sănătoase suficient timp pentru a utiliza MGMT pentru a preveni formarea legăturilor încrucișate.
„Acest profil unic sugerează potențialul său pentru tratamentul glioblastomului rezistent la medicamente, o arie cu o nevoie neacoperită semnificativă în clinică”, a declarat Bindra, profesor Harvey și Kate Cushing de Radiologie Terapeutică la Facultatea de Medicină Yale. Bindra este, de asemenea, director științific al Centrului pentru Tumori Cerebrale Familiale Chenevert de la Spitalul Smilo.
Herzon și Bindra au declarat că studiul lor evidențiază importanța luării în considerare a ratelor de modificare chimică a ADN-ului și de reparare biochimică a ADN-ului. Ei cred că pot folosi această strategie pentru a dezvolta tratamente pentru alte tipuri de cancer care conțin defecte specifice de reparare a ADN-ului asociate tumorii.
